آلاء محمد سدخان البيضاني1، ساره هاشم موسى1، حيدر كاطع حبيب القطيفي1
1 قسم علوم الأغذية، كلية الزراعة، جامعة البصرة، جمهورية العراق
بريد الكتروني: zenaalyounis@yahoo.com
HNSJ, 2023, 4(4); https://doi.org/10.53796/hnsj4423
تاريخ النشر: 01/04/2023م تاريخ القبول: 15/03/2023م
المستخلص
تتناول هذه المقالة العلمية أحدث ما توصلت اليها العلوم الحديثة في مجال انتاج اللحوم التي انتجت من زراعة الخلايا الحيوانية لتحل محل استهلاك منتجات اللحوم التقليدية اذ ان هذه العملية ممكن ان تمتلك القدرة على إحداث ثورة في صناعة اللحوم لما لها من آثار واسعة على البيئة والصحة. ومدى تقبلها من قبل المستهلك وكذلك تحفيز بعض البحوث الاقتصادية حول اللحوم المستزرعة وبالأخص المناقشة المستقبلية حول الطلب والعرض من اللحوم المستزرعة، إذ اعتمدت هذه المقالة على وجهات نظر التحليل العلمي الإنتاجي والصحي والاقتصادي والبيئي. يتغلب نظام إنتاج اللحوم في المختبر أيضًا على العديد من المشكلات المرتبطة بأنظمة إنتاج اللحوم التقليدية، مثل الذبح المفرط لحيوانات المنتجة للحوم، والأمراض المرتبطة بالتغذية، وسلالات مسببات الأمراض المقاومة للمضادات الحيوية، وانبعاثات غاز الميثان الهائلة التي تساهم في الاحتباس الحراري. نظرًا لأن الظروف في نظام إنتاج اللحوم في المختبر يتم التحكم فيها والتلاعب بها، سيكون من الممكن إنتاج لحوم مصممة وآمنة كيميائيًا وخالية من الأمراض على أساس مستدام. ومع ذلك، فهناك الكثير من الآراء تعتبر اللحوم المستنبتة غير طبيعية وتم رفضها من قبلهم، فمن المنظور الديني والثقافي ينقسم الناس في وجهات النظر اذ يعتبر البعض اللحوم المستنبتة استهتارًا بقوانين الله عــــــــــز وجــــــــــــــــل والــــــــــــــــــطبيعة، بــــــــــــــــينما يؤيدها الـــــــــــــــــــــبعض الآخــــــــر لأنها تمنع ذبح الحيوانات، لذلك هدفت هذه المقالة تسليط الضوء على هذه التقنية الحديثة وطرق انتاجها وميزاتها وعيوبها وطرح اراء الرفض والقبول لها.
Cultured meat and its nutritional, health and environmental effects between acceptance and rejection (A review)
A M Al –Baidhani1, Sara Musa1, and Haider k. Al- Qutaifi1
1 Department of Food Science, College of Agriculture, University of Basra, Republic of Iraq
Email: zenaalyounis@yahoo.com
HNSJ, 2023, 4(4); https://doi.org/10.53796/hnsj4423
Published at 01/04/2023 Accepted at 15/03/2023
Abstract
This scientific article deals with the latest findings of modern science in the field of meat production, which was produced from the cultivation of animal cells to replace the consumption of traditional meat products, as this process may have the ability to revolutionize the meat industry because of its wide effects on the environment and health. And the extent of its acceptance by the consumer, as well as stimulating some economic research on cultured meat, especially the future discussion about the demand and supply of cultured meat, as this article relied on the perspectives of scientific production, health, economic and environmental analysis. The in vitro meat production system also overcomes many of the problems associated with conventional meat production systems, such as excessive slaughter of meat-producing animals, nutrition-related diseases, antibiotic-resistant strains of pathogens, and massive methane emissions that contribute to global warming. As conditions in the laboratory’s meat production system are controlled and manipulated, it will be possible to produce tailored, chemically safe, disease-free meat on a sustainable basis. However, there are many opinions that consider cultured meat unnatural and were rejected by them. From a religious and cultural perspective, people are divided in viewpoints, as some consider cultured meat to be a disregard for the laws of God Almighty and Nature, while others support it because it forbids the slaughter of animals. The article sheds light on this modern technology, its production methods, advantages and disadvantages, and presents opinions of rejection and acceptance
المقدمة Introduction
اللحوم المزروعة (اللحم المستنبت Cultured meat، ويسمى أيضا اللحم النظيف clean meat، او اللحم الاصطناعي synthetic meat أو لحم المختبر in vitro meat، هو لحم مأخوذ من خلايا حيوانية يتم استنباته في المختبر بدلا من أخذه من اللحوم المذبوحة. وهو أحد أشكال الزراعة الخلوية) وهو إنتاج اللحوم خارج الحيوان في المختبر (Post et al., 2020). على وجـــــــــــه التـــــــحديد، يــــــــــتم إنــــــــــــتاج اللــــــــــــــحوم مـــــــــــن خــــــــــــلايا حـــــــــــــيوانية مستزرعة في وسط نمو في مفاعل حيوي (جهاز يتم فيه إجراء تفاعل أو عملية بيولوجية، خاصة على المستوى الصناعي) بدلاً من الحصول عليها مباشرة من الحيوانات المذبوحة. لذلك يتم إنتاجها بطريقة مختلفة جذريًا مقارنة بأساليب الثروة الحيوانية التقليدية. وتلاقي هذه العملية تأييد ودفاع من قبل العلماء والسياسيون. أصبحت هذه الفكرة الآن حقيقة تقنية، حيث بدأ تسويق اللحوم المستزرعة في الآونة الأخيرة اذ تعمل عديد من الشركات حاليًا على تطوير وتقديم منتجاتها إلى السوق (Rubio et al., 2020).


شكل (1): منتجات اللحوم المستزراعة
تعتبر اللحوم المستنبتة او المستزرعة هي ثورة تقنية بالإضافة الى انها ثورة اقتصادية ومجتمعية محتملة، حيث ان انتشارها قد يعطي إمكانية تعطيل قطاع اللحوم التقليدية. حيث أن الزراعة الحيوانية تستخدم أكثر من ثلاثة أرباع الأراضي الزراعية في العالم (Foley et al., 2011؛ Poore and Nemecek 2018). يـــــــــمكن للـــــــــــــحوم المــــــــــــــــــستزرعة ان تــــــــــحدث تــــــــــــــــغيرات كـــــــــــــبيرة فـــــــــــــــــــي مـــــــــــــــــعالجة الـــــــــــــــــعديد مــــــــــن الـــــــــــــــــــــقضايا مــــــــــــنها القضايا البيئية، مثل تلوث الهواء والتربة والمياه الذي تسببه الزراعة التقليدية (Tuomisto and Teixeira de Mattos 2011؛ Poore and Nemecek 2018). كما يمكن أن يقلل بشكل كبير من مخاطر الأمراض المعدية الناشئة، والتي ترتبط بشكل أساسي بتخزين وإنتاج واستهلاك الأغذية الحيوانية (Espinosa et al., 2020). نظرًا لأنه يمكن إنتاج اللحوم المستزرعة في ظروف مختبرية مسيطر عليها أثناء الظروف الخارجية غير المواتية، مثل الكوارث الطبيعية، فقد يؤدي ذلك إلى تقليل انعدام الأمن الغذائي العالمي. وبما أنه يتم إنتاجه في ظل ظروف معقمة، فيمكنه فعليًا القضاء على التلوث بالميكروبات والفايروسات المسببة للأمراض (Rubio et al., 2020).
على الرغم من أن هناك فوائد كبيرة للحوم المستنبتة، إلا أنه لا تزال هناك شكوك كبيرة، مثلا الراي المتداول بهذا الموضوع بأن هذا الابتكار يمكن أن يقلل بشكل كبير من تكلفة إنتاج اللحوم، إلى جانب العوامل الخارجية البيئية المرتبطة به. يبدو هذا الراي منطقيا في البداية، اذ إن إنتاج اللحوم المستزرعة لا يتطلب كل الموارد لتربية حيوان المزرعة والحفاظ عليه على قيد الحياة. ومع ذلك، هناك راي معارض هو ان تطور نمو العضلات داخل جسم الحيوانات، وطول ملايين السنوات الماضية يستغرق وقتا طويلا في تكوينها داخل جسم الحيوان، فانه قد يكون إنتاج العضلات بشكل مختلف مكلفًا وغير فعال من حيث استخدام الموارد. في الواقع، يلزم قدر كبير من الطاقة لإنتاج مكونات وسط النمو ولتشغيل المفاعل الحيوي (مثلا التحكم في درجة الحرارة والتهوية وعمليات الخلط) (Treich,2021).
أن تربية الحيوانات التي تحتاج الى أماكن صغيرة تكون مهمة للعيش في بعض البلدان الفقيرة، الا إن الحجة ضد التربية الحيوانية كبيرة في البلدان الغنية اذ تحتاج الى مساحات واســـــــــعة. كما ان أزمة COVID-19 اظهرت إن الغذاء الحيواني هو أصل معظم الأمراض المعدية الناشئة، إما بشكل مباشر من خلال انتقال الامراض من الحيوانات البرية والداجنة، أو بشكل غير مباشر من خلال التوسع الزراعي والتكثيف يجعل تماس مباشر ما بين الانسان ومواشيهم(Treich,2021).
ان استهلاك اللحوم يثير مجموعة من القضايا الصحية. فبينما تحتوي اللحوم على بعض العناصر الغذائية المهمة (كالبروتينات والدهون والفيتامينات والاملاح المعدنية المهمة)، الا ان الاستهلاك المفرط للحوم الحمراء والمعالجة وغيرها من المنتجات الحيوانية ارتــــــــــــــبط بالعديد من النتائج الصحية الضارة، مثل أمــــــــــــــــراض القــــــــــــــــلب والشــــــــــــرايين والســــــــــــــــكري من النـــــــــــــــــــــــوع 2 والسمنة والعديد من السرطانات وغيرها (Willett et al., 2019).
تشير الدراسات إلى أن المنتجات الحيوانية على شكل لحوم وتربية الأحياء المائية والبيض ومنتجات الألبان تستخدم حوالي 83٪ من الأراضي الزراعية في العالم وتساهم بحوالي 57٪ من انبعاثات الأغذية المختلفة، بينما توفر فقط 37٪ من البروتين و18٪ من السعرات الحرارية بالإضافة الى الآثار البيئية السلبية على خمسة أبعاد: انبعاثات غازات الاحتباس الحراري (GHG)، واستخدام الأراضي والمياه، وتحميض المحيطات (تلوث المحيطات بانبعاثات غاز CO2 )، والتغذيات(فرط المغذيات هي عملية زيادة المواد الغذائية في المياه بمركّبات تحتوي على الآزوت(N) والفسفور في نظام بيئي ما سواء كان في الماء أو على اليابسة). (Poore and Nemecek 2018).
من المعروف أن التحكم في تلوث المياه أمر معقد بسبب المصادر المتعددة والمنتشرة للتلوث، كما أن مراقبة رفاهية الحيوانات في كل مزرعة تعتبر مهمة شاقة. بشكل عام ان المزارع عديدة ومبعثرة مما يجعل التنظيم صعبًا. وهذا يجعل تنفيذ التدابير التنظيمية المحلية الصارمة أكثر صعوبة، مما قد يؤدي إلى تكاليف اقتصادية محلية وتسرب التلوث العالمي (Bonnet et al., 2020).
تاريخ اللحوم المستزرعة History of cultured meat
- كانت فكرة اللحوم المستزرعة موجودة منذ فترة طويلة، ولكن بدون التقنية اللازمة لتحقيقها. تم ذكر اللحوم الــــــــمستنبتة لأول مـــــــــــــرة فـــــــــــي عام 1897 في رواية خــــــــــــيال عـــــــــــلمي الـــــــــــــــمانية بعنوان (على كوكبين) Auf Zwei Planeten، وظهرت في عدد من الروايات الأخرى في القرن الماضي، مثل Ashes، Ashes رماد رماد (بقلم رينيه بارجافيل 1943).
- في عام 1907، زرع عالم الأحياء روس هاريسون خلايا عصبية للضفدع في وسط ليمفاوي في جامعة جونز هوبكنز. ومع ذلك، لم يحدث الكثير فيما يتعلق بتطوير اللحوم المستزرعة حتى نهاية القرن العشرين.
- في أواخر التسعينيات، قدم ويليم فان إيلين أول براءة اختراع لطريقة إنتاج اللحوم المستزرعة.
- في عام 1998، قامت الإدارة الوطنية للملاحة الجوية والفضاء (ناسا) بزراعة لحوم الأسماك الذهبية في المختبر كجزء من بعض الأبحاث لإنتاج الغذاء لرحلات طويلة عبر الفضاء.
- أن أول لحم مستنبت يستهلكه الإنسان كان من خلال عمل أورون كاتس. في مشروعه لعام 2003، المطبخ غير المجسم، تمكن من استنبات خلايا من الضفدع وقدمها كشرائح لحم الضفادع الصغيرة خلال عشاء في متحف في نانت، فرنسا (Catts and Zurr 2007).
- فــــــــــــــــي عـــــــــــــــــام 2005 مولت الحكومة الهولندية مشروعين بحثيين حول اللحوم المستزرعة (Stephens et al., 2018)، وشارك الباحث الطبي، مارك بوست، وأحد مؤسسي Google، سيرجي برين، لتسريع تطويرها.
- صدر أول منشور علمي عن اللحوم المستزرعة في عام 2008، وزاد عدد المنشورات بشكل كبير منذ عام 2013 (Chriki and Hocquette 2020).
- في عام 2008، نظم معهد أبحاث الغذاء في النرويج مؤتمرا حول اللحوم المستزرعة.
- ازداد الظهور العام على نطاق واسع بعد عرض تلفزيوني في عام 2013 في لندن حيث طهي بوست اللحوم المستزرعة وتذوقها صحفيان علنًا، معلنين أنه “كان قريبًا من اللحم”.
- حدث أول تسويق لمنتجات اللحوم المستنبتة في ديسمبر 2020 في مطعم في سنغافورة.
- لعبت منظمتان غير ربحتين، حصاد جديد New Harvest، ولاحقًا، معهد الغذاء الجيد Good Food Institute، دورًا رئيسيًا في دعم البحث والتطوير للحوم المستنبتة.
- تم (ولا يزال) يتم تنفيذ الكثير من العمل المتقدم في هذا المجال داخل الشركات الناشئة. في الوقت الحاضر، يوجد حوالي 50 شركة ناشئة حول اللحوم والمأكولات البحرية. تقع معظم الشركات الناشئة حاليًا في الولايات المتحدة والاتحاد الأوروبي، مع وجود عدد قليل من الشركات الإضافية في إسرائيل وآسيا معظم المستثمرين هم من القطاع الخاص. ولكن أيضًا قطاع اللحوم التقليدي والشركات الكبيرة في الولايات المتحدة (Cargill أو Tyson Foods) أو في الاتحاد الأوروبي (PHW أو Migros أو Grimaud) دخلت ضمن هذا المجال. المبالغ المستثمرة زادت بشكل كبير خلال السنوات الماضية، لكنها ظلت متواضعة مقارنة بالاستثمارات في شركات الأغذية النباتية (Treich,2021).
الإنتاج Production
إن التقنية الأساسية المستخدمة في إنتاج اللحوم المستزرعة تعتمد على هندسة الأنسجة، وهي ليست جديدة. ركزت هذه التقنية بشكل كبير على التطبيقات الطبية، مثل الطب التجديدي، والنماذج غير الحيوانية في المختبر المستخدمة في علم السموم وتطوير الأدوية. لم يتم حتى الآن رفع إنتاج اللحوم المستزرعة إلى المستوى الصناعي، ومن الصعب معرفة بدقة ما الذي تركز عليه الشركات الناشئة بالضبط. ومع ذلك، فإن المبادئ العامة معروفة. (Tuomisto 2018).
باختصار تؤخذ الخلايا الجذعية من الأنسجة العضلية أو الأجنة ويتم توسيعها أولاً ثم تفريقها إلى خلايا عضلية. يتم وضع هذه الخلايا أيضًا في مفاعل حيوي حيث تتكاثر، ويتم نقلها إلى مصفوفة أو سقالة لتنمو إلى ألــــــــــــياف عضلية وأنسجة أكبر. يبدو أن وسيط النمو هو الجانب الحاسم، من حيث التكلفة والشكوك (Specht 2020؛ Post et al., 2020). لا يزال البحث والتطوير في اللحوم المستزرعة يواجه عددًا من التحديات التقنية. على الأرجح، يجب إنتاج البركر والناجتس قبل تناول شرائح اللحم بوقت طويل. في الواقع، يتطلب نمو نسيج عضلي كامل بشبكته من الأغشية والخيوط نظامًا معقدًا مع أنواع خلايا متعددة تنمو بطريقة منظمة، وهيكل به شبكة أوعية دموية متكررة. قد يكون الحصول على رخامي اللحم أمرًا صعبًا أيضًا. علاوة على ذلك، لم يتضح بعد كيفية إنتاج اللون الطبيعي في المختبر أو طراوة اللحوم بسبب عملية النضج الطبيعي (Hocquette 2016). بالنسبة للمنتج المفروم، يختلف القياس أيضًا عن منتج اللحوم كامل السماكة، خاصة بالنسبة للمرحلة النهائية من إنتاج العضويات أو الأنسجة (Post et al., 2020). وبالتالي، من المحتمل أن تكون تقنيات اللحوم المستزرعة طريقة ما لتكون قادرة على إعادة إنتاج تنوع ومـــــــــــــلمس مـــــــــــــــــنتجات اللحوم المختلفة (Chriki and Hocquette 2020). عـــــــــــلاوة عــــــــــــلى ذلك، لـــــــــــــــيس من الواضح أي أنواع الخلايا أو المنتجين مـــــــــــــــــــــــتوسطي النمو في المستقبل سيستخدمون. ومع ذلك، يبدو من شبه المؤكد أن التقنية لن تعتمد على المنتجات المشتقة من الحيوانات، مثل مصل الأبقار الجنيني المستخدم في المراحل المبكرة في وسط النمو (Specht 2020) أو الكولاجين البقري المستخدم في السقالة (Young and Skrivergaard 2020). على أي حال لا تزال هناك حاجة إلى إدخال تحسينات فنية كبيرة على عملية إنتاج اللحوم المستزرعة لتكون فعالة من حيث التكلفة ويتم إنتاجها على نطاق واسع للإمداد بالغذاء، بدءًا من اختيار الخلايا والتحسين المتوسط إلى المواد الحيوية وهندسة الأنسجة (Post et al., 2020). يتكون اللحم الصالح للأكل من عضلات الهيكل العظمي إلى جانب الخلايا الدهنية والخلايا الليفية والخلايا الرابطة والكريات البيض، مما يعطي النكهة والملمس وأخيراً يجعله مستساغًا. يلخص الشكل 2. العملية التي ينطوي عليها إنتاج اللحوم المستزرعة. يتم فصل الخلايا الجذعية عن خلايا العضلات وتحت ظروف نمو مناسبة مثل درجة الحرارة والأكسجين والمغذيات وعوامل النمو، تنمو الخلايا وتتكاثر لتشكيل أنابيب عضلية متعددة النوى. وسائط الاستنبات عبارة عن مصل حيواني يتم استخراجه من البالغين من الحيوان أو حديثي الولادة أو الجنين (Sharma et al.,2015) يــــــــنتج عـــــــــــــن نـــــــــــــــضج الأنبوب العضلي تكوين ألياف عضلية وينتهي الأمر بنمو ألياف العضلات إلى منتج يحاكي اللحوم (بالنسبة للتركيب المختبري للحوم المستزرعة، فإن العناصر الرئيسية هي الخلايا، والبروتينات، ووسائط الاستزراع، والسقالة، وعوامل النمو وظروفه، والتي تمت مناقشة بعضها أدناه (Gaydhane et al.,2018).
- اختيار الخلايا Choice of cells
تُفضل الخلايا الجذعية الجنينية (ES) وخلايا الجذعية العضلية والخلايا المتخصصة في الأنسجة العضلية كمصدر للخلايا العضلية Pandurangan and Kim,2015)). تمتلك سلالات الخلايا الجذعية الجنينية إمكانات تجديد غير محدودة ولكن الطفرات يمكن أن تتراكم مع الأجيال وتحتاج إلى تخليق محدد لإنتاج خلايا العضلاتAmit et al., 2000) ). أيضًا، حتى الآن، لم يتم إنشاء أي خلايا ES في الأبقار أو الخنازير أو الأغنام Talbot and Blomberg, 2008)). على الرغم من أن خلايا الجذعية العضلية محدودة في التجدد، إلا أنها يمكن أن تحاكي بشكل أوثق تكوّن العضل Bach et al.,2003)). الخلايا اما الجذعية البالغة وهي خلايا الجذعية العضلية التي لها إمكانات متعددة السلالات. نوع آخر من الخلايا مناسب لإنتاج اللحوم في المختبر هو الخلايا الجذعية البالغة المشتقة من الدهون. القلق الرئيسي بشأن الخلايا الجذعية البالغة هو ميلها نحو التحول الخبيث في الزراعة طويلة الأمد. كما أنهم يخضعون لتحول غير مرغوب فيه في الزراعة طويلة الأمد. ومن ثم، فإن استخدام الخلايا الجذعية العضلية هو أكثر أهمية من حصاد الخلايا الجذعية البالغة المشتقة من الدهون (Gaydhane et al.,2018).
شكل (2): رسم تخطيطي لإنتاج اللحوم المستزرعة (Gaydhane et al.,2018)
- السقالة Scaffolding to Cultured Meat
تتضمن زراعة الخلايا المنتظمة سقالة لدعم تكاثر الخلايا. تتطلب تكوين العضلات Myoblasts والقدرة على الانكماش التلقائي. وبالتالي، يجب أن توفر السقالات مساحة كبيرة وأن تكون مرنة للسماح بالتقلص وزيادة الانتشار المتوسط ويمكن فصلها بسهولة عن مزرعة اللحوم. المواد الشائعة للاستخدام والتي تكون الأفضل هي مواد طبيعية وصالحة للأكل؛ وفي نفس الوقت لا يمكن تجاهل مواد السقالات غير الصالحة للأكل. بينما يمكن ترك السقالات الصالحة للأكل في النظام، يمكن أن توفر السقالات غير الصالحة للأكل خصائص مثيرة للاهتمام. يمكن استخدام البوليمرات الصالحة للأكل وغير الصالحة للأكل على سبيل المثال الكولاجين والسليلوز كمادة أساسية للسقالة لأنها ستوفر المسامية للهيكل (Williams,2012). اقترحوا Edelman et al., (2005) خرزًا مساميًا مصنوعًا من الكولاجين الصالح للأكل كركيزة، بينما اقترح Van Eelen et al., (1999) اقترح شبكة كولاجين من أصل بقري والتي توصف أيضًا بإسفنجة الكولاجين. يساعد هيكل الإسفنج في زيادة مساحة السطح وانتشاره، ولكنه قد يعيق حصاد الأنسجة. تم استخدام خرزات Cytodex-3 microcarrier كسقالات في المفاعلات الحيوية الدوارة ولكن المشكلة الرئيسية هي عدم القدرة على التمدد. تتمثل إحدى الطرق الفعالة للتمديد الميكانيكي للخلايا العضلية في استخدام كريات مجهرية مسامية صالحة للأكل وحساسة للمنبهات مصنوعة من السليلوز أو كيتوزان أو الألجينات أو الكولاجين والتي ستخضع لتغير بنسبة 10٪ في مساحة السطح على الأقل، بعد تغييرات طفيفة في درجة الحرارة أو الرقم الهيدروجيني. بمجرد أن تلتصق الخلايا العضلية بالكرات، يمكن شدها بشكل دوري بشرط ألا يؤثر هذا التباين في درجة الحموضة أو درجة الحرارة سلبًا على تكاثر الخلايا والالتصاق والنمو. ان التحدي الرئيسي مع التقنية القائمة على السقالة هو إزالة نظام السقالات، عادة ما يتم فصل صفائح الخلايا المزروعة ميكانيكيًا أو إنزيميًا لكن العيب الرئيسي هو أنها تلحق الضرر بالخلايا والمصفوفة خارج الخلية Edelman et al.,2005)). صمم Silva et al., (2007) طلاءًا مستجيبًا للحرارة يخضع عند درجة حرارة منخفضة للتغيير من كاره للماء إلى محب للماء ويطلق صفائح سليمة من الخلايا المستنبتة والمصفوفة خارج الخلية عند التبريد. يعطي فرصة لتكديس الألواح لإنتاج منتجات ثلاثية الأبعاد. أبلغ (Lam et al.,(2009 عن طريقة لإزالة المزرعة كصفيحة متكدسة من سطح غير لاصق مغطى باستخدام التحلل الحيوي لامينين بروتين معين (Lam et al.,2009). الشكل 3 يظهر الشكل التخطيطي للسقالة القائمة على اللحوم المختبرية.
شكل (3): يظهر الشكل التخطيطي للسقالة القائمة على اللحوم المختبرية.
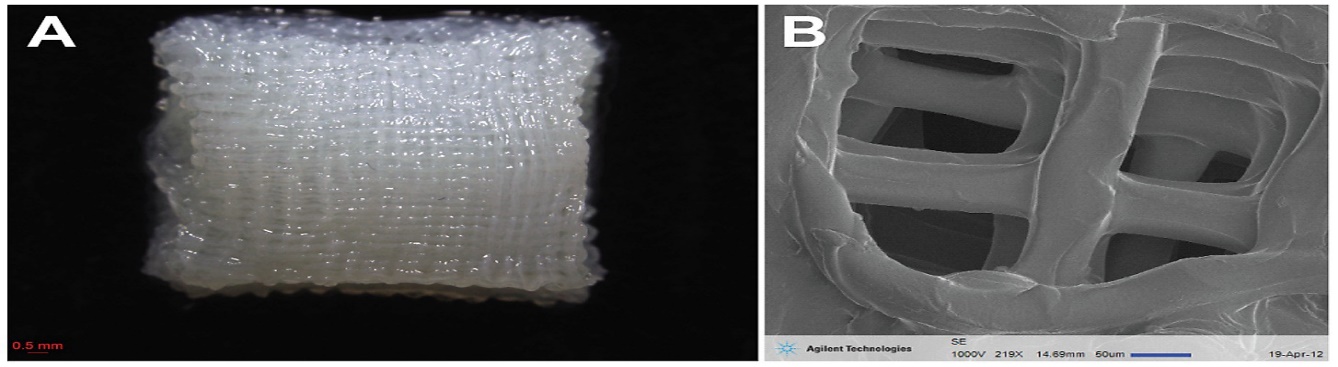
شكل (4): أنواع السقالات المستخدمة في زراعة اللحوم المختبرية
- ظروف الزرع Culture condition
- وسط الزرع: إحدى المهام الصعبة في إنتاج اللحوم في المختبر هي الصياغة الصحيحة لوسط الاستزراع. يجب أن تدعم الوسيلة وتعزز النمو مع كونها مصنوعة من مكونات صالحة للأكل وبأسعار معقولة ومتاحة بكميات كبيرة. عادةً ما تُزرع الخلايا العضلية في مصل حيواني مأخوذ من حيوان بالغ أو مولود جديد أو مصدر جنيني. مصل بقري الجنين هو المكمل القياسي لوسائط زراعة الخلايا ومع ذلك، فإن المصدر في الجسم الحي متغير في التكوين وهو حامل محتمل للعوامل المسببة للأمراض. تعتبر الوسائط التجارية والوسائط الخالية من المصل الخالية تمامًا من أي مكون مشتق من الحيوانات مثالية، أحد الأمثلة على المصل المتوفر تجارياً هو Ultroser G. يتكون تكوين هذا المصل بشكل أساسي من عامل النمو وعامل الالتصاق والبروتين المرتبط والفيتامينات والمعادن والهرمونات الضرورية لنمو الخلايا حقيقية النواة. يحتوي على خُمس البروتين الموجود في مصل الحيوانات فقط، ومع ذلك فإن نمو ونضج الأنسجة أسرع من المتوسط الذي يتكون من مصل بقري جنيني. ومع ذلك، فإن المشكلة الرئيسية هي ارتفاع تكلفتها. ذكرت بعض الابحاث ان المصل المكون من مستخلص الفطر والتي تحقق معدل نمو أعلى من مصل بقري الجنين وهي فعالة من حيث التكلفة (Gaydhane et al.,2018) (Benjaminson et al., 2002).
- العامل التنظيمي: يعد تصميم تركيبة مناسبة من الوسائط بالهرمونات وعوامل النمو مجال عمل مهم أيضًا. عوامل النمو ضرورية لنمو الخلايا وانتشارها. يمكن إضافة عوامل النمو المنقى أو الهرمونات إلى وسط الاستزراع من النباتات أو الحيوانات أو الأنواع البكتيرية المعدلة وراثيا والتي تولد البروتينات المؤتلفة. يمكن للخلايا الكبدية المزروعة بشكل مشترك إنتاج عوامل نمو شبيهة بالأنسولين والتي تعزز تــــــــــــــــــــــــكاثر الـــــــــــــــــــــــــــــــخلايا الــــــــــــــــعضلية وأيضًا تكاثر الخلايا الجذعية العضلية في بعض الحيوانات (Cen et al., 2008).
- المفاعل حيوي Bioreactor
المفاعل الحيوي (هو جهازٍ أو نظامٍ يدعم البيئة النشطة بصورةٍ حيويةٍ. إحدى الأمثلة على المفاعلات الحيوية، نجد أن المفاعل الحيوي هو وعاء يتم إجراء العملية (التفاعلات) الكيميائية التي تشتمل الكائنات الحية أو المواد النشطة الكيميائية الحيوية المشتقة من الكائنات الحية المختلفة. وهنا قد تكون مثل تلك العمليات هوائية أو لاهوائية. وغالباً ما يكون شكل هذه المفاعلات الحيوية أسطوانية الشكل، تتراوح في أحجامها من سعة الليترات إلى الأمتار المكعبة، كما أنها غالباً ما تكون مصنوعة من سبائك الفولاذ المقاوم للصدأ (ستانلس ستيل). هذا وقد يشير المفاعل الحيوي إلى تلك الآلة أو النظام المعني بنمو الخلايا أو الأنسجة الحية في إطار زرع الخلايا. وتم تطوير تلك الأجهزة لتُسْتَخْدَمُ في مجال هندسة النسج) (IUPAC,1992). يجب أن يكون تصميم المفاعل الحيوي بحيث يحفز نمو الأنسجة. يعتمد نجاح زيادة إنتاج اللحوم المستزرعة على التغطية الكافية للأوكسجين أثناء بذر الخلايا وزراعتها على السقالة، يتم التوسط في نضح الأوكسجين الكافي بواسطة المفاعلات الحيوية مما يزيد من النقل الجماعي بين وسط الاستزراع والخلايا. يدور مفاعل حيوي لوعاء الجدار الدوار بطريقة توازن سرعته بين قوة الطرد المركزي وقوة السحب وقوة الجاذبية وتسمح المزرعة ثلاثية الأبعاد بالغرق في الوسط مما يساعد في تطوير بنية الأنسجة المماثلة لتلك الموجودة في الجسم الحي. يوفر هذا النوع من المفاعلات الحيوية نقلًا عاليًا للكتلة مع الحد الأدنى من إجهاد القص. نوع آخر من المفاعلات الحيوية هو مفاعل حيوي نضح مباشر إنها أكثر ملاءمة للزراعة القائمة على السقالة. هنا، يتدفق الوسط عبر سقالة مسامية مع تبادل الغازات يحدث في حلقة مائع خارجية. يوفر هذا النوع من المفاعلات الحيوية نقلًا عاليًا للكتلة مع إجهاد قص كبير. حاملات الأكسجين: تعتمد قابلية الخلايا على البقاء والكثافة على تدرج الأوكسجين في مزارع الأنسجة الكاملة النمو (Radisic et al., 2008). يمكن إضافة ناقلات الأوكسجين إلى الوسط للحفاظ على ارتفاعها تركيز الأوكسجين. هناك نوعان من ناقلات الأوكسجين، أحدهما عبارة عن نسخة محسنة من الهيموغلوبين والآخر عبارة عن مواد كيميائية مشبعة بالفلور مطورة صناعيًا. تتراوح التقنيات المستخدمة في إنتاج اللحوم الاصطناعية من زراعة الخلايا والأنسجة التي تمارس حاليًا إلى الاستراتيجيات قيد التطوير مثل طباعة الأعضاء، والتصنيع الحيوي وتقنية النانو القائمة عليه (Gaydhane et al.,2018).
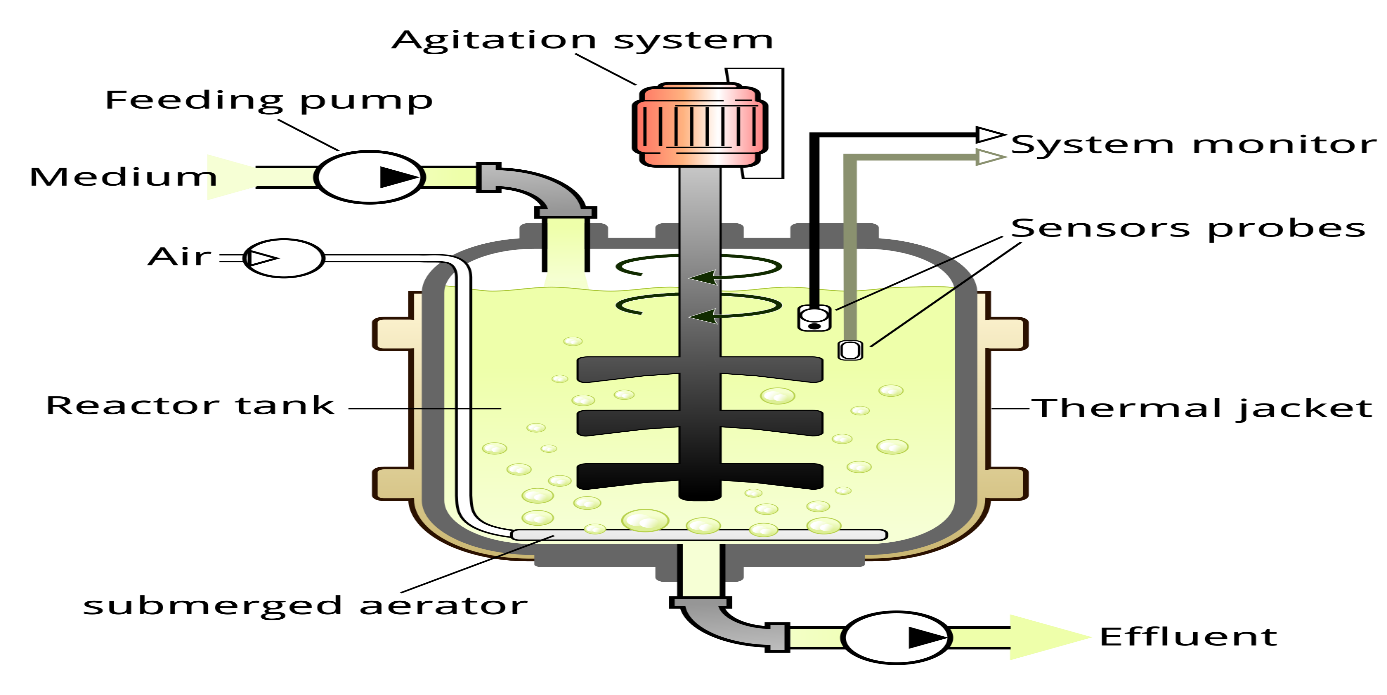
الشكل (5): مخطط يبين المفاعل حيوي Bioreactor (Gaydhane et al.,2018)
- زراعة الخلية أو تقنية السقالات Cell culture or scaffolding technique
تُستخدم السقالة كناقل للخلايا العضلية الجنينية أو الخلايا الجذعية العضلية المشتقة من الحيوانات من خلال استئصال نسيج من الجسد biopsy. بشكل عام، تُستخدم الشبكات الشبكية القائمة على الكولاجين أو الخرز الصغير كسقالة لأنها متوافقة حيوياً وقابلة للتحلل. يتم إدخال الخلايا المزروعة على السقالات في مفاعل حيوي ثابت أو دوار مملوء بالمغذيات. يتم دمج الخلايا لتشكيل أنابيب عضلية تتمايز إلى ألياف عضلية بمساعدة وسائط التمايز. تنتج هذه التقنية لحمًا طريًا متماسكًا أو لحمًا منزوعًا من العظم يمكن استخدامه لتحضير البيركر والنقانق وإلخ. العيب الرئيسي المرتبط بهذه التقنية هو أنها لا تستطيع إنتاج لحوم عالية التنظيم أو ثلاثية الأبعاد على سبيل المثال شرائح اللحم. الاستزراع المشترك للخلايا العضلية الليفية والخلايا الليفية هو الأسلوب المحتمل لإنتاج اللحوم في المختبر. في الوقت الحاضر، هناك اقتراحان مفصلان لإنتاج اللحوم في المختبر باستخدام زراعة الخلايا أحدهما اقترحه فلاديمير ميرونوف لوكالة ناسا والآخر قدمه ويليم فان إيلين الحائز على براءة اختراع عالمية لنظام مماثل. وفقًا لاقتراح فلاديمير ميرونوف، يـــــــــتم استـــــــــــــــخدام مفاعل حيوي لتنمية الخلايا في كرة كولاجين حيث يتم ربطها وتمييزها، بينما يستخدم اقتراح ويليم فان إيلين شبكة كولاجين ويتم تجديد وسط الزرع بشكل متكرر (Noor et al.,2015) (Gaydhane et al.,2018).
- تقنية التنظيم الذاتي أو زراعة الأنسجة
Self‑organizing or tissue culture technique
تم دراسة هذه التقنية بواسطة Benjaminson et al., (2002) اذ استخرجوا جزء العضلات والهيكل العظمي من السمكة الذهبية ووضعوا في أوساط استنبات مختلفة تحتوي على مصل بقري جنيني وخلاصة مسحوق السمك وخلاصة الفطر لمدة أسبوع يُظهر النبات المستأصل مساحة سطح 14٪ عند وضعه في وسط يحتوي على مصل بقري جنيني لوحظت مساحة سطح 13٪ عند وضعها في مستخلص فطر عش الغراب Mushroom. لوحظ زيادة في المساحة السطحية لزراعة الأنسجة بنسبة تصل إلى 79٪ عند وضعها في وسط يحتوي على خلية عضلية هيكلية من سمك الدُرُبّ أو الكاراسيوس (هو جنس من الأسماك ينتمي لفصيلة شعاعيات الزعانف من الشبوطيات) المنفصلة Benjaminson et al., 2002))، يـــحتوي الجزء المستأصل على جميع الأنسجة ووسائط النمو بنسب دقيقة تحاكي حالة الجسم الحي ينتج عن تقنية التنظيم الذاتي لحوم هيكلية ثلاثية الأبعاد واقعية للغاية مثل اللحم المشكل الطبيعي، العيب الوحيد المرتبط بتقنية التنظيم الذاتي هو إذا كانت الخلايا يتم فصلها عن وسط المغذيات بمسافة تزيد عن 0.5 مم، مما يجعلها نخريه بسبب نقص إمداد الدم Bhat et al.,2017)).
- طباعة الجهاز Organ printing
تتضمن هذه التقنية رش الخلايا الحية أو كرات الخلايا في طبقات فوق الجل الذي يعمل بمثابة ورق طباعة. في وقت لاحق، يتم دمج الخلايا لإنشاء هيكل ثلاثي الأبعاد من أي شكل. هذه تقنية متقدمة يمكنها الاهتمام بقوام اللحوم وتكوين الأوعية الدموية ورخامة الدهون وعناصر أخرى من اللحوم التقليدية مثل المذاق والمظهر. لديها القدرة على إنتاج العضو بأكمله، العيب الوحيد في هذه التقنية هو أنها باهظة الثمن وقيد التطوير (Boland et al.,2003).
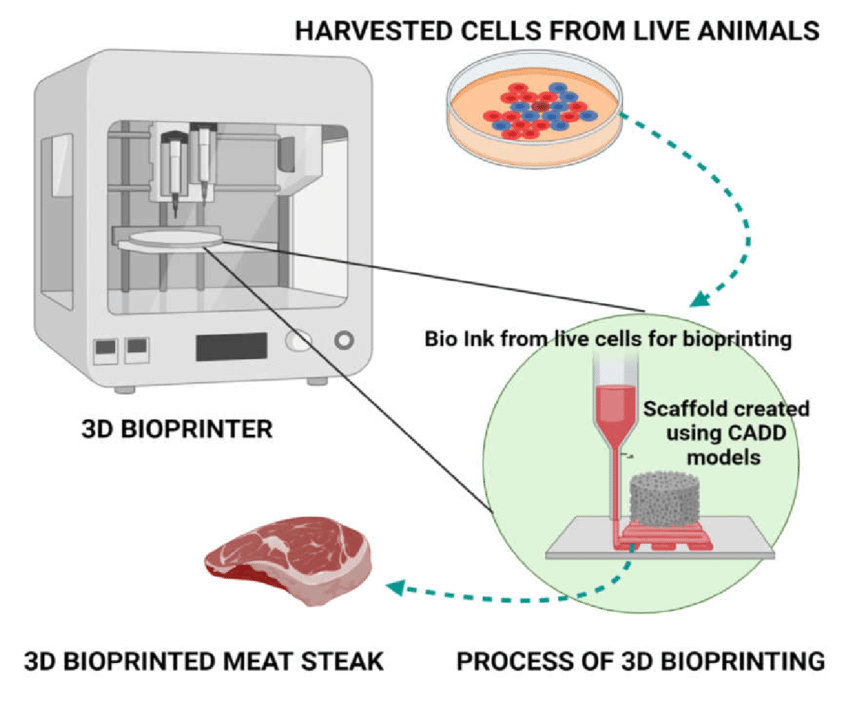
شكل (6): مخطط لطريقة الطباعة 3D (Boland et al.,2003)


شكل (7): بعض طرق الطباعة الحيوية
- تقنية النانو Nanotechnology
يعمل خبراء تقنية النانو على إنشاء روبوتات نانوية nanorobots أو لغة برمجية مجمِّعه assembler يمكنه بشكل انتقائي تجميع الذرات أو الجزيئات المتشابهة لتشكيل الهيكل بأكمله. يمكن أن تخلق فعليًا أي مادة من أي شكل مرغوب فيه في حالة بدائية (Boland et al.,2003).
القيمة الغذائية Nutritional value
بالإضافة إلى احتواء اللحوم على نسبة عالية من البروتين مع مجموعة كاملة من الأحماض الأمينية، فإنها تعد مصدر حصري للعديد من العناصر الغذائية الأساسية. من الضروري أن يفي منتج اللحوم المزروعة في المختبر بالقيمة الغذائية لمنتجات اللحوم التقليدية، إن لم يكن يتجاوزها، ليكون قادرًا على المنافسة في السوق. يجب استكمال العناصر الغذائية الموجودة في اللحوم في الجسم الحي والتي لا يتم تصنيعها بواسطة خلايا العضلات. على سبيل المثال، يتم تصنيع فيتامين ب 12 الأساسي حصريًا بواسطة أنواع معينة من البكتيريا المستعمرة للأمعاء، وبالتالي يوجد فقط في المنتجات الغذائية من أصل حيواني. سيكون من الضروري إضافة فيتامين ب 12 المتبلور الذي يتم إنتاجه تجاريًا عن طريق التخمر الميكروبي التخليقي الحيوي في منتج اللحوم في المختبر المزروع في بيئة معقمة. يوجد الحديد في اللحوم على هيئة أيون الحديد (II) في شكل الهيم المتوفر بيولوجيًا بدرجة عالية، وهي مجموعة prosthetic الموجودة في المايوغلوبين. لتوفير الحديد للخلايا العضلية النامية في شكل متاح حيويًا، يجب تكملة أيونات Fe (III) المرتبطة ببروتين ترانسفيرين المرتبط بالبلازما إلى وسط المزرعة. عن طريق نقل الحديد بوساطة الترانسفيرين، يمكن للحديد أن يدخل الميتوكوندريا العضلية ويتم دمجه في تخليق الهيم وتخليق الميوغلوبين اللاحق (Aisen et al., 2001) وتجدر الإشارة إلى أنه يجب مراقبة مستويات الترانسفيرين عن كثب، حتى لا تسمح بوجود أيونات حديد أو حديد حرفي الوسط، اذ يمكنها بسهولة تحفيز حدوث عملية الاكسدة الضارة عند وجود الاوكسجين. بالإضافة إلى ذلك يعتبر فيتامين ب 12 وحديد الهيم عنصرين مهمين بشكل خاص ومغذيين من مصادر اللحوم حصريًا للعديد من العناصر. يتمثل التحدي الكبير في إنتاج منتج لحوم منافس في المختبر في ضمان وجود جميع العناصر الغذائية الضرورية. غالبًا ما تتطلب المعادن والفيتامينات الغذائية التي لا يتم تصنيعها بواسطة الخلايا العضلية بروتينات ملزمة في آليات نقل متوسطة وفعالة للدخول إلى الخلايا، تعد معرفة التمثيل الغذائي المعقد لكل من الفيتامينات والمعادن المهمة ضرورية لتطوير منتج لحوم ذي قيمة غذائية. في حين أن تحديد ملف المغذيات المناسب سيكون عقبة رئيسية يجب التغلب عليها، فإنه يأتي مع معرفة كيفية التلاعب بنظام الزراعة لصنع منتجات مصممة خصيصًا للتغذية، يتطلب إنتاج اللحم المستنبت مادة حافظة مثل بنزوات الصوديوم لحماية اللحم النامي من التخمر والفطريات. يستخدم مسحوق الكولاجين، صمغ الزانثان، المانيتول والدودة القرمزية بطرق مختلفة في هذه العملية (Datar and Betti,2010).
دور التعديل الوراثي The role of genetic modification
تقنيات الهندسة الوراثية، مثل إدراج أو لحذف أو إيقاف أو تنشيط أو تغيير الجين، غير مطلوبة لإنتاج اللحوم المستنبتة. علاوة على ذلك، فاللحوم المستنبتة تتألف من نسيج أو مجموعة أنسجة، وليست عضية كاملة. ومن ثم، فهي ليست عضية معدلة وراثية. ولأن اللحوم المستنبتة هي ببساطة خلايا تم استنباتها في بيئة مراقبة واصطناعية، يرى البعض أن اللحوم المستنبتة أقرب للخضروات المزروعة مائية، بدلا من كونها خضروات معدلة وراثية وعلى الرغم من انعقاد الكثير من الأبحاث حول اللحوم المستنبتة، وعلى الرغم من إن انتاج اللحوم المستنبتة لا يتطلب تقنيات الهندسة الوراثية، فهناك نقاش بين الباحثين حول توظيف مثل هذه التقنيات لتحسين كمية واستدامة اللحوم المستنبتة. إن تعزيز اللحوم المستنبتة بالمغذيات مثل الأحماض الدهنية المفيدة هو أحد التحسينات التي يمكن تسهيلها من خلال التعديل الوراثي. يمكن القيام بنفس التحسين بدون تعديل وراثي، عن طريق التلاعب في ظروف وسط الاستنبات. كما قد تلعب الهندسة الوراثية دورة في تكاثر الخلايا العضلية. إدخال معاملات تنظيم الأرومة العضلية، معاملات النمو، أو المنتجات الوراثية الأخرى في الخلايا العضلية قد يزيد من القدرة التقليدية السابقة لإنتاج اللحوم التقليدية (Datar and Betti,2010).
الصحة والسلامة Health and safety
يتم تقديم اللحوم المستنبتة أيضًا على أنها أكثر صحة، لأنه يتم إنتاجها في المختبر في ظل ظروف خاضعة للرقابة. لأنها لا تحتاج الى نظام تربية ماشية باستخدام طرق مكثفة ولا توجد ضرورة للمضادات الحيوية. ومع ذلك، فإن المضادات الحيوية تم استخدامها أثناء إنتاج أول بيركر مستنبت، لا تمتلك مزارع الخلايا جهاز مناعة. يفترض أن المضادات الحيوية لن تكون ضرورية بعد الآن بمجرد أن يصبح الإنتاج على نطاق واسع في أنظمة معقمة ممكنًا (Amit et al.,2000). ومع ذلك، لا يزال من غير الواضح ما إذا كانت المضادات الحيوية وإلى أي درجة ضرورية لمزارع الخلايا. ومن المحتمل أن تكون صحية أيضًا، نظرًا لأن إنتاج اللحوم المستزرعة يتطلب اتصالًا ضئيلًا أو معدومًا مع الحيوانات، يتم تقليل خطر الإصابة بالأمراض الحيوانية المنشأ. انتشار الأمراض الحيوانية المنشأ من الأمراض التي يمكن أن تنتقل من الحيوان إلى الإنسان ومن الإنسان إلى الحيوان. ومع ذلك، مصل العجل الجنيني ومكونات حيوانية أخرى يمكن أن تأوي الأمراض المعدية. لذلك فإن البديل غير الحيواني هو الحل المرغوب. تؤكد العديد من الدراسات الاتصال بين الإفراط في استهلاك اللحوم والسمنة وأمراض القلب والأوعية الدموية وارتفاع ضغط الدم والسكري من النوع 2 (Amit et al.,2000). هنا أيضًا، ليس من الواضح ما إذا كانت هذه المخاطر الصحية ستنجم أيضًا عن الاستهلاك المفرط وإلى أي درجة من اللحوم المستزرعة. علاوة على ذلك، يمكن للحوم المستنبتة أن تصبح غذءًا وظيفيًا، بمعنى غذاء غني بالعناصر الغذائية مثل الفيتامينات أو الأحماض الدهنية n-3 والـــــــــتي تـــــــــــــضاف اثناء عملية التصنيع من أجل تحقيق تأثير إيجابي على صحة الإنسان. ومع ذلك، فإن الآثار الصحية المنسوبة إلى الأغذية الوظيفية ليست على نطاق واسع علميًا مثبتة Asakura et al.,2001)).
تسويق اللحوم المستزرعة Commercialization Cultured Meat
في عام 2015، أعلن صانعو البيركر المختبري أن سعر البيركر قد انخفض من 325000 دولار إلى 11.36 دولارًا أو 80 دولارًا للكيلوغرام الواحد من اللحوم المختبرية. الأسعار الحالية لمصادر البروتين الطبيعي لكل كيلوغرام هي اللحم المفروم 5.6 دولار، ولحم البقر منزوع العظم 9 دولارات، ولحم الخنزير على العظم 7.4 دولارات، والدجاج الكامل 2.6 دولار. في غضون عامين فقط انخفض السعر بشكل كبير وهي علامة جيدة لتسويق اللحوم المختبرية. تقدمت الشركات الناشئة الصغيرة مثل Memphis Meat (سان فرانسيسكو، كاليفورنيا) وSuper Meat (إسرائيل) وMosa Meat (هولندا، بدعم من Mark Post) لــــــــــتقديم اللــــــــــحوم الـــــــــــنظيفة في الــــــــــــــــمختبر إلى السوق في غضون السنوات الخمس المقبلة (Shoemaker, 2016). ومع ذلك بسبب الافتقار إلى اللوائح والارتباك بين الإدارات التنظيمية لأصحاب الشركات المنتجة، يشعر العديد من رواد الأعمال الصغار بالقلق بشأن الموافقة على اللحوم المزروعة في المختبر. من أجل الحصول على الموافقة، همهم الرئيسي هو خلق تشابه من المنتج الجديد مع اللحوم الموجودة، والتي ثبت بالفعل أنها آمنة. في عام 2017 اتخذ البيت الأبيض زمام المبادرة في مراجعة الخطوات التي اتخذتها الوكالات الأمريكية لتنظيم التكنولوجيا الحيوية الزراعية، وتدرس الأكاديميات الوطنية للعلوم والهندسة والطب، في واشنطن بالتفصيل حول التطورات واللوائح المستقبلية للتكنولوجيا الحيوية. ومن المتوقع أن يؤدي ذلك إلى تسريع تشكيل القوانين والأنظمة للحوم المستزرعة مما يؤدي الى زيادة في التسويق التجاري السريع (Devitt. 2016).
التكلفة The Cost
لا يمكن حل المشكلة إلا عندما يزداد معدل إنتاج واستهلاك اللحوم المستزرعة في وقت واحد. يمكن أن يؤدي تحسين مزارع الخلية للإنتاج على نطاق واسع إلى خفض التكلفة في النهاية. يمكن للخلية المفردة أن تعطي تريليون خلية، لذا يمكن استخدامها لأجيال خلايا متعددة. أيضًا، إذا تمكنت الحكومة من تقديم دعم للإنتاج مثل دعمها للأعمال الزراعية الأخرى، فمن المؤكد أنها ستساعد في خفض التكلفة (Gaydhane et al.,2018).
- المنظور العام
على الرغم من اعتبار اللحوم المستنبتة غير طبيعية ورفضها عدد قليل من الناس، إلا أن هناك أيضًا مجموعة من الأشخاص الذين قدّروها لأنها صديقة للحيوان وصحية وآمنة. في المستقبل، قد يصفه الأطباء ويستخدم كغذاء طبي حيث يمكن التحكم في محتويات اللحوم مثل الدهون والبروتينات والحديد. من المنظور الديني والثقافي، ينقسم الناس في وجهات النظر. يعتبر البعض اللحوم المستنبتة استهتارًا بقوانين الله عــــــــــز وجــــــــــــــــل والــــــــــــــــــطبيعة، بــــــــــــــــينما يؤيدها الـــــــــــــــــــــبعض الآخــــــــر لأنها تمنع ذبح الحيوانات (Gaydhane et al.,2018).
اجُــــــــــــريت عدة دراسات لفهم ومعرفة مدى تأثير توفر المعلومات عن اللحوم المستزرعة للمستهلك لهذا النوع من اللحوم وما لها من تأثير على استهلاكه ومن هذه الدراسات الدراسة التي اجريت من قبل Rolland et al.(2020) اذ شارك فيها مائة وثلاثة وتسعون مستهلك قسموا على ثلاث مجموعات عمرية مختلفة من كلا الجنسين ، كل منهم تلقى معلومات عن الفوائد المجتمعية أو الفوائد الصحية أو معلومات عن جودة ومذاق اللحوم المستنبتة وتذوقوا قطعتين من البيركر الاولى تمثل بيركر اللحم البقري الاعتيادي والقطعة الثانية البيركر المصنع من اللحم المستنبت، على الرغم من أن كلا القطعتين كانت مصنعة بالطرق التقليدية. اذ تم إجراء التحليل الحسي ضمن استمارات معدة لهذا الغرض، لاحظوا الباحثين أن توفير المعلومات وتجربة التذوق زاد من قبول اللحوم المستزرعة وأن المعلومات المتوفرة عن الفوائد التغذوية للحوم المستنبتة زادت القبول أكثر من المعلومات المتعلقة بالجودة والطعم وان الوعي المسبق للحوم المستزرعة هو أفضل مؤشر على قبولها على عكس الدراسات السابقة، لم يرتبط نوع الجنس والحالة الاقتصادية والاجتماعية بمعدلات القبول المختلفة. ومن الجدير بالذكر أن 58٪ من المستجيبين أبدوا استعدادهم لدفع الارتفاع في سعر للحوم المستنبتة تزيد عن 37٪ عن سعر اللحوم العادية. تذوق جميع المشاركين البيركر المستزرع وقاموا بتقييم مذاقه ليكون أفضل من التقليدي على الرغم من عدم وجود اختلاف بين مذاق وشكل النوعين. كانت هذه هي أول دراسة قبول للحوم المستنبتة حيث عُرض على المشاركين تناول وتقييم اللحوم التي تم تصنيفها على أنها مستزرعة. استنتجوا الباحثين في هذه الدراسة أن الحصول على معلومات إيجابية يحسن بشكل مهم القبول والاستعداد للتذوق وأن المحتوى المحدد للمعلومات له أهمية ثانوية وان الوعي باللحوم المستنبتة هو أفضل مؤشر على القبول.
References
- Aisen, P., Enns, C., & Wessling-Resnick, M. (2001). Chemistry and biology of eukaryotic iron metabolism. The international journal of biochemistry & cell biology, 33(10), 940-959.
- Amit, M., Carpenter, M. K., Inokuma, M. S., Chiu, C. P., Harris, C. P., Waknitz, M. A., Itskovitz-Eldor, J. & Thomson, J. A. (2000). Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Developmental biology, 227(2), 271-278.
- Asakura, A., Rudnicki, M. A., & Komaki, M. (2001). Muscle satellite cells are multipotential stem cells that exhibit myogenic, osteogenic, and adipogenic differentiation. Differentiation, 68(4-5), 245-253.
- Bach, A. D., Stern-Straeter, J., Beier, J. P., Bannasch, H., & Stark, G. B. (2003). Engineering of muscle tissue. Clinics in plastic surgery, 30(4), 589-599.
- Benjaminson, M. A., Gilchriest, J. A., & Lorenz, M. (2002). In vitro edible muscle protein production system (MPPS): Stage 1, fish. Acta astronautica, 51(12), 879-889.
- Bhat, Z. F., Kumar, S., & Bhat, H. F. (2017). In vitro meat: A future animal-free harvest. Critical reviews in food science and nutrition, 57(4), 782-789.
- Boland, T., Mironov, V., Gutowska, A., Roth, E. A., & Markwald, R. R. (2003). Cell and organ printing 2: Fusion of cell aggregates in three‐dimensional gels. The Anatomical Record Part A: discoveries in molecular, cellular, and evolutionary biology, 272(2), 497-502.
- Bonnet, C., Bouamra-Mechemache, Z., Réquillart, V., & Treich, N. (2020). Regulating meat consumption to improve health, the environment and animal welfare. Food Policy, 97, 101847.
- Catts O, Zurr I (2007) Semi-living art. In: Kac E (ed) Signs of life: bio art and beyond. MIT Press, Cambridge, pp 231–247.
- Cen, S., Zhang, J., Huang, F., Yang, Z., & Xie, H. (2008). Effect of IGF-1 on proliferation and differentiation of primary human embryonic myoblasts. Zhongguo xiu fu chong jian wai ke za zhi= Zhongguo xiufu chongjian waike zazhi= Chinese journal of reparative and reconstructive surgery, 22(1), 84-87.
- Chriki, S., & Hocquette, J. F. (2020). The myth of cultured meat: a review. Frontiers in nutrition, 7, 7.
- Da Silva, R. M., Mano, J. F., & Reis, R. L. (2007). Smart thermoresponsive coatings and surfaces for tissue engineering: switching cell-material boundaries. TRENDS in Biotechnology, 25(12), 577-583.
- Datar, I., & Betti, M. (2010). Possibilities for an in vitro meat production system. Innovative Food Science & Emerging Technologies, 11(1), 13-22.
- Devitt, E. (2017). Artificial chicken grown from cells gets a taste test—But who will regulate it. Science (80-.)., Mar. Sci AAAS. http://www.scien cemag .org/news/2017/03/artificial -chick en-grown -cells -gets-taste -testwho- will-regul ate-it. Accessed 3 Dec 2017.
- Edelman, P. D., McFarland, D. C., Mironov, V. A., & Matheny, J. G. (2005). Commentary: In vitro-cultured meat production. Tissue engineering, 11(5-6), 659-662.
- Espinosa, R., & Treich, N. (2021). Animal welfare: Antispeciesism, veganism and a “life worth living”. Social Choice and Welfare, 56(3), 531-548.
- Foley, J. A., Ramankutty, N., Brauman, K. A., Cassidy, E. S., Gerber, J. S., Johnston, M. & Zaks, D. P. (2011). Solutions for a cultivated planet. Nature, 478(7369), 337-342.
- Gaydhane, M. K., Mahanta, U., Sharma, C. S., Khandelwal, M., & Ramakrishna, S. (2018). Cultured meat: state of the art and future. Biomanufacturing Reviews, 3(1), 1-10.
- Hocquette, J. F. (2016). Is in vitro meat the solution for the future?. Meat science, 120, 167-176.
- Lam MT, Huang YC, Birla RK, Takayama S (2009). Microfeature guided skeletal muscle tissue engineering for highly organized 3-dimensional free-standing constructs. Biomaterials 30:1150– 1155. https ://doi.org/10.1016/j.bioma teria ls.2008.11.014.
- Noor, S., Radhakrishnan, N. S., & Hussain, K. (2016). Newer trends and techniques adopted for manufacturing of In vitro meat through “tissue-engineering” technology: a review. Int J Biotech Trends Tech, 19, 14-9.
- Pandurangan, M., & Kim, D. H. (2015). A novel approach for in vitro meat production. Applied microbiology and biotechnology, 99(13), 5391-5395.
- Poore, J., & Nemecek, T. (2018). Reducing food’s environmental impacts through producers and consumers. Science, 360(6392), 987-992.
- Post, M. J. (2014). Cultured beef: medical technology to produce food. Journal of the Science of Food and Agriculture, 94(6), 1039-1041.
- Post, M. J., Levenberg, S., Kaplan, D. L., Genovese, N., Fu, J., Bryant, C. J. & Moutsatsou, P. (2020). Scientific, sustainability and regulatory challenges of cultured meat. Nature Food, 1(7), 403-415.
- Radisic, M., Marsano, A., Maidhof, R., Wang, Y., & Vunjak-Novakovic, G. (2008). Cardiac tissue engineering using perfusion bioreactor systems. Nature protocols, 3(4), 719-738.
- Rolland, N. C., Markus, C. R., & Post, M. J. (2020). The effect of information content on acceptance of cultured meat in a tasting context. PLoS One, 15(4), e0231176.
- Rubio, N. R., Xiang, N., & Kaplan, D. L. (2020). Plant-based and cell-based approaches to meat production. Nature Communications, 11(1),1-11.
- Sharma, S., Thind, S. S., & Kaur, A. (2015). In vitro meat production system: why and how? Journal of food science and technology, 52(12), 7599-7607.
- Shoemaker, N. (2017). Price of lab-grown burger falls from $325 K to $11.36. Big Think. Big Think. http://bigth ink.com/ideaf eed/answe ringhow- a-sausa ge-gets-made-will-be-more-compl icate d-in-2020. Accessed 3 Dec 2017.
- Specht, L. (2020). An analysis of culture medium cost and production volumes for cultivated meat. The Good Food Institute. Technical report.
- Stephens, N., Di Silvio, L., Dunsford, I., Ellis, M., Glencross, A., & Sexton, A. (2018). Bringing cultured meat to market: Technical, socio-political, and regulatory challenges in cellular agriculture. Trends in food science & technology, 78, 155-166.
- Talbot, N. C., & Blomberg, L. A. (2008). The pursuit of ES cell lines of domesticated ungulates. Stem cell reviews, 4(3), 235-254.
- Treich, N. (2021). Cultured meat: Promises and challenges. Environmental and Resource Economics, 79(1), 33-61.
- Tuomisto HL (2018). The eco-friendly burger. EMBO Reports 20, 1, First published: 14 December 2018 Van der Weele C, Tramper J (2014) Cultured meat: Every village its own factory? Trends Biotechnol 32:294–296.
- Van Eelen, W. F., Van Kooten, W. J., & Westerhof, W. (1999). Industrial scale production of meat from in vitro cell cultures. Patent. http://www.wipo.int/pctdb/en/wo.jsp
- Willett, W., Rockström, J., Loken, B., Springmann, M., Lang, T., Vermeulen, S. & Murray, C. J. (2019). Food in the Anthropocene: the EAT–Lancet Commission on healthy diets from sustainable food systems. The Lancet, 393(10170), 447-492.
- Williams J (2012). Meat derived from stem cells: how, what and why. http://medli nk-uk.net/wp-conte nt/uploa ds/pathp rojec tsste mcell s2012 /Willi amsJ.pdf.
- Young, J. F., & Skrivergaard, S. (2020). Cultured meat on a plant-based frame. Nature Food, 1(4), 195-195.

