Production in vitro et caractérisation physique et chimique de La “Spiruline (Arthrospira Platensis) dans l’Etat de Laghouat
Benaya lalia1 Benaya fatima2
1 Université Amar Teledji Laghouat. Laboratoire de biologie Email :benayalalia1@gmail
2 Centre universitaire Sharif Bouchoucha Aflou . Laboratoire d’études juridiques et économiques Email : f.benaya@cu-aflou.edu.dz
HNSJ, 2024, 5(5); https://doi.org/10.53796/hnsj55/29
Publié le 01/05/2024 reçu au 01/04/2024 Accepté le 09/04/2024
Résumé
Le travail présente une contribution à étudie la possibilité de produire in-vitro une espèce de micro-algue et de l’élaboration d’une fiche technique concernant les facteurs déterminants des conditions expérimentales et le degré énergétique de l’algue.
Les résultats obtenus ne a permis de déterminer les limites de l’optimum (préférendum) où la température moyenne était 34°C et le pH moyen égal à 10. La salinité de l’eau était lorsque devient plus élevée, la culture de spiruline était réussie et facile.
L’analyse de la composition biochimique de l’algue nous à montrer que notre souche (Arthospira platensis) présente un taux de protéine brute égale à 43.78% et un taux de glucide de 17.1%.
Vu l’importance de sa composition énergétique, il est le temps de pensé a développé cette filière des activités et de culture en Laghouat.
Mots Clés: Spiruline, culture in-vitro, physico-chimiques, Biomasse, qualité biochimique, Laghouat
Research Article
In vitro production and physical and chemical characterization of “Spirulina (Arthrospira Platensis) in the State of Laghouat
Abstract
The work presents a contribution to study the possibility of producing in-vitro a species of micro-algae and the elaboration of a technical sheet concerning the determining factors of the experimental conditions and the energetic degree of the seaweed.
The results obtained did not make it possible to determine the limits of the optimum (preferendum) where the average temperature was 34 ° C and the average pH equal to 10. The salinity of the water was when becomes higher, the spirulina culture was successful and easy.
The analysis of the biochemical composition of the alga shows us that our strain (Arthospira platensis) has a crude protein level equal to 43.78% and a content of 17.1%.
Given the importance of its energy composition, it is time to think developed this sector of activities and culture in Laghouat.
Key Words: Spirulina, In-vitro culture, Physicochemical, Biomass, Biochemical quality, Laghouat.
Introduction
La production alimentaire a soulevé de nombreux problèmes, en particulier ces derniers temps, qui ont suscité une grande controverse causée par une pénurie de production alimentaire, l’incapacité de répondre aux besoins des consommateurs et le manque de nourriture pour eux, entraînant la faim, la malnutrition et la propagation des maladies et des épidémies dans de nombreux pays du monde.
Pour réduire ces problèmes, il existe d’autres solutions. Pour éviter ces problèmes, il faut prêter attention aux sources non traditionnelles, c’est-à-dire celles qui n’ont pas été exploitées ou qui ont été mal exploitées jusqu’à présent. Parmi les ressources recommandées, les plus rentables et les plus utiles, figure la culture de micro algues, comme la spiruline. Ce sont les cyanobactéries qui ont longtemps attiré l’attention de nombreux chercheurs en tant que sources de protéines et d’autres substances (Kihlberg, 1972 dans Rao, 1981).
Notre travail cherche à répondre aux questions suivantes :
La possibilité et comment mettre en œuvre la production de spiruline à travers l’installation en laboratoire d’une ferme aquacole avec la détermination des facteurs physiques et chimiques et du milieu de culture appropriés.
Tester la valeur énergétique de cette spiruline produite dans des conditions de laboratoire universitaire.
Pour cette raison, la problématique de recherche s’articulait autour de deux parties :
Le premier partie : Matériels et Méthodes
Le deuxième partie : Résultats et Discussions
le premier partie : Matériels et Méthodes
.1Choix et intérêt du microorganisme
La spiruline est un microorganisme exceptionnel, ayant de multiples utilités agroalimentaire, pharmaceutique, écologique et biotechnologique.
.2Le but
L’objectif de ce projet est de produire ce type d’algue appelé spiruline et de l’utiliser comme composant de base dans les cosmétiques en raison de ses composants essentiels : protéines à 70%, antibiotiques et antioxydants et complément alimentaire pour les sportive
.3 Station d’étude
Toutes les expérimentations à savoir : installation de l’incubateur, préparation du milieu de culture, mise en culture et test biochimique, sont tous réalisé au niveau du laboratoire de biologie de l’Université Amar Thlidji-Laghouat.
|
|
|
|
A : Station géographique de Laghouat |
B: Localisation du lieu d’exploitation |
Figure 01 : Présentation de la zone d’étude
4 .Méthodologie
Dans le but de la réalisation d’une culture in-vitro nous avons préparés tous les moyens expérimentaux à savoir, l’appareillage, l’eau de forage ,la souche mère de spiruline et les produits chimiques.
5. La qualité de l’eau utilisée
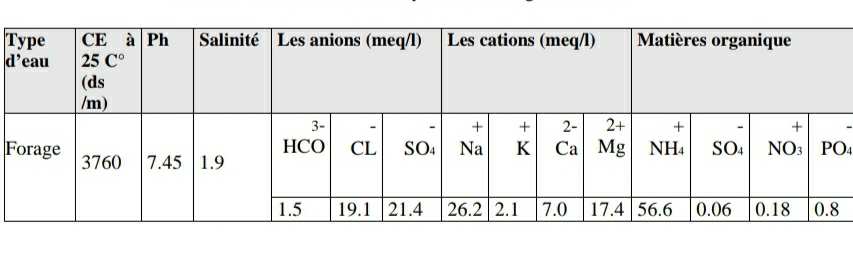 Afin de réalise notre expérimentation au niveau de laboratoire, nous avons utilisée l’eau de forage, et le tableau ci-dessous présentes résultats de l’analyse
Afin de réalise notre expérimentation au niveau de laboratoire, nous avons utilisée l’eau de forage, et le tableau ci-dessous présentes résultats de l’analyse
physico-chimique : Tableau 01 : Résultats d’analyse d’eau forage
6.Matériel utilisé
 6.1/ Installation de l’aquarium
6.1/ Installation de l’aquarium
Figure 02 : Préparation de l’aquarium
 6.2/ Matériel de laboratoire
6.2/ Matériel de laboratoire
Figure 03: les matériaux utilisés au laboratoire
6.3 /Les produits chimique
Préparation des produits chimiques et des solutions


Figure 04 : Les produits chimiques utilisés dans la préparation de Milieu de culture de Jourdan
6.4 /Conditions expérimentales
-Espace suffisant et propre.
-Aération,
-Avoir un bon éclairage par l’utilisation du papier aluminium sur les quatre façades.
-Température ambiante


figure 05 : installation de l’aquarium
7. milieu de culture de Jourdan
|
Pour 10 litre |
|
|
Les éléments |
Quantité g/l |
|
Bicarbonate de soude |
160g |
|
Nitrate de potassium |
20g |
|
Sel |
10g |
|
Sulfate de fer |
0.1g |
|
Sulfate de magnésium |
1g |
|
Sulfate de potassium |
5g |
|
Chlorure de calcium |
1g |
|
Phosphate d’ammonium |
1g |


.
figure 06: Les différentes étapes de préparation de milieu de culture
8. Ensemencement
1/ Préparation 1 litre de milieu de culture final (mélange d’eau+ produits chimique)
2/ Mise en culture dans l’aquarium
3/ Conditionnement et contrôle des paramètres (lumière, agitation, température et pH).

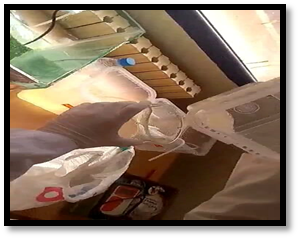

figure 07 :les étapes Ensemencement
9.Agitation

 Une agitation permettre aux cellules l’accès aux nutriments et à la lumière
Une agitation permettre aux cellules l’accès aux nutriments et à la lumière
figure 08: Photo représente l’application de l’agitation automatique
10. Éclairage
En plus à l’éclairement naturel nous avons installés une source lumineuse pendant toute la période de l’expérimentation 24h/24h.

Figure 09 : Installation d’une source lumineuse
11. Récoltes et filtration
Après formation du bulle, nous avons observons la présence d’une couche de spiruline à la surface de l’eau, à l’aide d’une cuillère en récupère en maximum la couche de la spiruline et filtres par des papiers filtré puis plaçons dans des boîtes de Pétri.




Figure 10: Les étapes de récolte et filtration de la biomasse de spiruline (originale)
12. séchage

 c’est une bonne façon de conserver la spiruline sur une longue période , on a fait essorée et séchée à l’air libre par des plaques en plastique pendant 24h
c’est une bonne façon de conserver la spiruline sur une longue période , on a fait essorée et séchée à l’air libre par des plaques en plastique pendant 24h


 Figure 11: Poudre de spiruline originale
Figure 11: Poudre de spiruline originale
le deuxième partie : Résultats et Discussions
Lorsque nous fournissons toutes les conditions favorables pour la production de spiruline (l’eau du forage, Température et pH appropriée et salinité modérée), nous obtenons les résultats suivants.
1. Résultats de la phase initiale
Après préparation milieu qui composée de spiruline et l’eau de forage, aussi sel et bicarbonate de sodium comme des éléments du base pendant 1 mois pour leur développer afin de commençons à l’appliquer milieux de la culture du (Jourdan, 2006). Nous avons remarqué une évolution remarquable du changement de quantité et de couleur.
|
|
|
|
|
|
1er semaine |
2eme semaine |
3eme semaine |
4eme semaine |
Figure 12 : Résultat de la phase initiale a compté
A chaque fois nous avons remarqué changement de la couleur de la spiruline du vert foncé au vert clair et aussi notez que la quantité de spiruline augmente de manière relative remarquable.
2.Résultats de la phase finale
Cette phase c’est une l’étape fondamentale de la prolifération de spiruline qui due à la disponibilité de matériaux essentiels et des conditions nécessaires à leur développement.
2.1/ Évolution des paramètres physico-chimiques
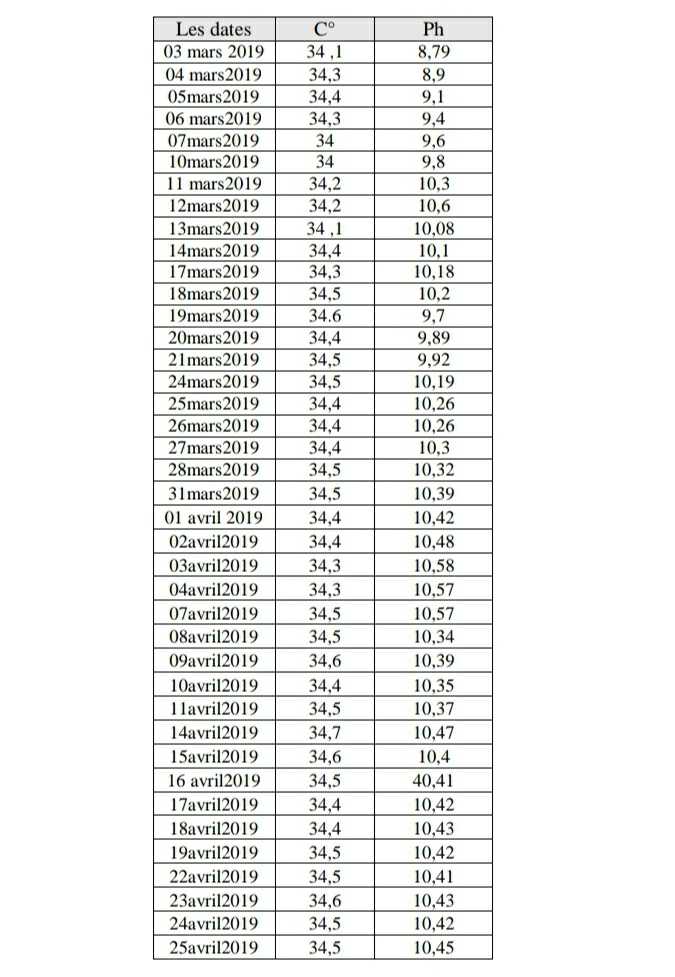
La température (T°C) et le potentiel Hydrogène (pH)sont les deux paramètres mesurés systématiquement durant toute la période de culture de Spiruline. Les valeurs enregistrées sont récapitulées dans le tableau suivant.
Tableau 03 :Évolution de la température et du pH des cultures de Spiruline
- La température
-Pour le mois mars la valeur maximale est de 34,5 °C et minimale de 33,4 °C
 -Pour mois d’avril la valeur maximale est de 34,7 °C et minimale de 34,3°C
-Pour mois d’avril la valeur maximale est de 34,7 °C et minimale de 34,3°C
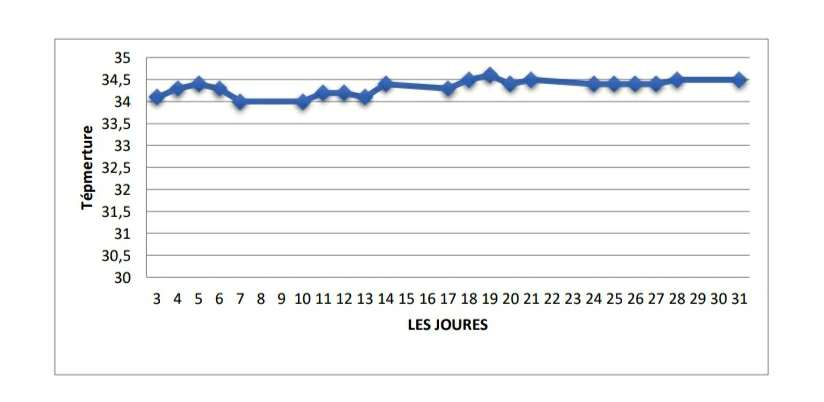
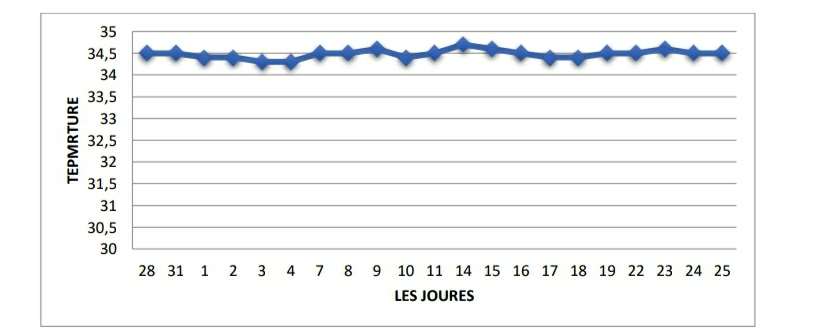 Figure 13 :Évolution de la température in-vitrodurant le mois de mars
Figure 13 :Évolution de la température in-vitrodurant le mois de mars
Figure 14 :Évolution de la température in-vitro durant le mois d’Avril
- Le potentiel Hydrogène (pH) :
Les résultats de notre mesure de pH montrent une valeur moyenne égale à 10 qui reflète un aspect alcalin des eaux de l’aquarium.
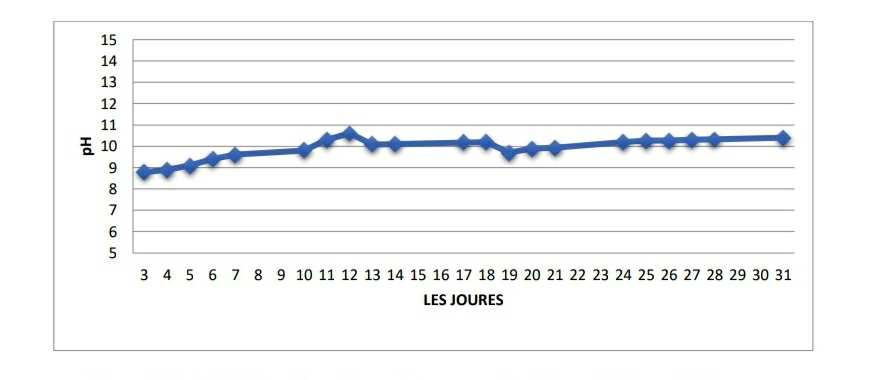 Figure 15: Variations des valeurs de mesures du pH pendant le mois de mars
Figure 15: Variations des valeurs de mesures du pH pendant le mois de mars
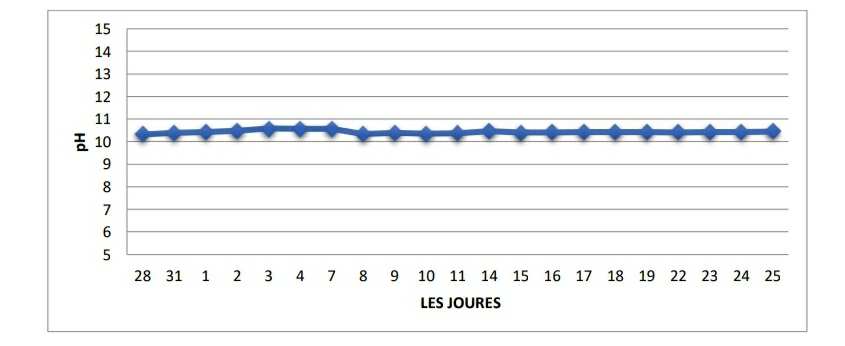
Figure 16 : Variations des valeurs de mesures du pH pendante le mois d’avril



Figure 17 : Observation macroscopique (œil nue) des différents aspects morphologiques couleur et la quantité de la spiruline (photo originale)
A chaque fois nous observant grâce au microscope optique les différents changements de couleur de la spiruline .
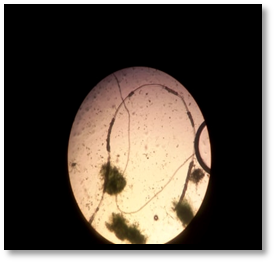

Figure 18 : la spiruline observée au microscope optique (ObjectifX40)
3.2Estimation de la biomasse produite
La biomasse de la Spiruline analysée a été récoltée chaque 2 semaine pendant toute la période de culture in-vitro. Les valeurs correspondantes de la T°C, pH, la masse de la poudre ainsi la date ont été effectués en parallèle.
Tableau 04 : Les résultats des mesures de la température et du pH durant la récolte de la biomasse
|
Dates |
T°C |
pH |
Volume d’eau en (ml) |
La masse en (gr) |
|
14/03/2019 |
33,8 |
10,1 |
200 |
0.5 |
|
31/03/2019 |
33,5 |
10,39 |
200 |
1 |
|
11/04/2019 |
33,2 |
10,37 |
200 |
1.9 |
|
16/04/2019 |
34 |
40,41 |
200 |
2.5 |
|
|
|
|
|
|
14/03/2019 |
31/03/2019 |
11/04/2019 |
11/04/2019 |
Figure 19 : Chronologie de l’évolution de la biomasse de la spiruline
Après le calcul, nous obtenons les résultats montrés dans le tableau suivant et ceci après l’achèvement de la production.
Tableau 06: Estimation de la biomasse sèche de la spiruline
|
Volume d’eau en ml |
La masse en g |
|
200 |
2.5 |
|
6000 |
75 |
4.Résultats de l’analyse biochimique
4.1/Teneur en protéines
La teneur en protéines brutes est l’un des critères utilisés pour évaluer la valeur nutritive d’un aliment. L’évaluation du taux de protéines brutes d’algue Spiruline. par la méthode de Kjeldhal (1883) révèle qu’elle contient environ 43.78% de protéines. 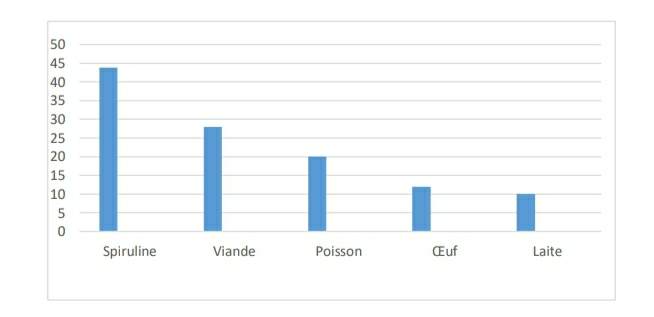
Figure 20 : Taux de protéine de notre spiruline en comparaison avec les autres aliments
4.2/Teneur en glucides
L’évaluation du taux de glucides totaux par la méthode de Dubois et al (1956), indique que les glucides constituent globalement 15 à 25% de la matière sèche des spirulines(Jourdan, 1999).
La teneur de glucides dans notre travail est 17.1%. Cette valeur était excellente et très importante pour le besoin du l’homme et même aussi pour l’animal.
Conclusion
Les résultats obtenus ne a permis de conclure :
– que la qualité de l’eau, la température et le pH sont considéré comme des facteurs essentiale pour le conditionnement in-vitro de la production de la spiruline car l’eau de forage est l’une des facteurs les plus importants qui contrôlent le succès du milieu en raison de son impact direct sur la production.
– On peut dire aussi que plus la salinité de l’eau était élevée, plus l’application de la culture de spiruline était réussie et facile.
– Le rôle fondamental de la température et Le pH dans le développement et la prolifération de la spiruline.
– Nous avons pu déterminer les limites de l’optimum (préférendum) où la température et le pH sont responsables sur l’une des processus de prolifération et la vitesse de croissance. Donc notre spiruline s’accroitre mieux dans des températures moyennes de 34°C et un pH moyen de 10.
– L’analyse de la composition biochimique de l’algue nous à montrer que notre souche (Arthospira plantais) présente un taux de protéine brute égale à43.78% ; ce dernier considéré comme un rendement faible en comparaison avec d’autre souches et méthodes de production. Néanmoins l’estimation du taux de glucides indique une valeur très motivante avec 17.1%.
Référence Bibliographique
- Cruchot.H, 2008. La Spiruline, Bilan et Perspective. Thèse docteur en pharmacie. Université de France-Comite.
- .H, (1993) La Spiruline, algue de vie. Bull. Inst. Océanog. Monaco, n° spécial 12:7-11.
- Feldmann, J, (1966). Les types biologiques d’Algues marines benthiques. Bulletin de la Société Botanique de France, 113(sup2), 45-60.
- Fox R.D, (1986) “Algoculture : la spirulina, un espoir pour le monde de la faim”, Edisud, Aix-en-Provenc
- Fox R.D, (1999).Spiruline Technique, pratique et promesse. EDISUD, Aix-en Provence. p 246.
- Falquet, J., & Hurni, J. P. (1986). Spiruline: aspects nutritionnels. Flamant vert.
CH-1201 Genève, Suisse. P. 1-16.
- Falquet J. et Hurni J-P. (2006). Spiruline : aspects nutritionnels. Antenna Technologies.
- Geitler .L, (1932). Cyanophyceae. In : Rabenhorst’s Kryptogamenflora von Deutschland, Tiruchirapalli, Inde.
- Jourdan J.P. (1999).Cultivez votre spiruline : Manuel de culture artisanale, Genéve, PP85, 63.
- Jourdan J.P,(1999). sugar as a source of carbon for spirulina (Artrospira platensis) culture, international biotechnology,Inde, PPP58,96,97.
- Jourdan J.P, (2006). Cultivez votre spiruline : manuel de culture artisanal .Publication Antenna Technologies.
- Jourdan J.P. 2007. Manuel de culture de la Spiruline. Antenna
- Technologies. Disponible sur:
http://www.antenna.ch/documents/manuelJourdan2o6l.pdf
- Kihlberg R,1972. The microbe as a source of food. Annu. Rev. Microbiol P427, 466.
- Léonard, J. (1968). Discovery, ecology and nutritional utilization of Spirulina platensis.
- chimiques sur la connaissance et la photosynthèse de Spirulina maxima.Thèse de doctorat, Paris.