دراسة عن فعالية مستخلصات حبوب البن المائية والكحولية ضد بكتريا Streptococcus mutans
Study of the Antimicrobial efficiency of Aqueous and Ethanol Extract against Streptococcus mutans
هناء ونيس الفلاح1
1 قسم الأحياء الدقيقة، كلية العلوم، جامعة المرقب، ليبيا.
بريد إلكتروني: hanafallah33@gmail.com
DOI: https://doi.org/10.53796/hnsj62/18
المعرف العلمي العربي للأبحاث: https://arsri.org/10000/62/18
الصفحات: 228 - 236
تاريخ الاستقبال: 2025-01-04 | تاريخ القبول: 2025-01-15 | تاريخ النشر: 2025-02-01
المستخلص: القهوة من بين السلع الأكثر تداولًا والمشروبات المستهلكة في جميع أنحاء العالم في المقام الأول لتأثيراتها المنشطة. علاوة على ذلك، من المعروف أن القهوة تحتوي على مركبات نشطة بيولوجيًا مختلفة ذات فوائد صحية كبيرة بما في ذلك الأنشطة المضادة للبكتيريا. تم اختبار مستخلصات القهوة الخضراء والمحمصة المائية (البارد، الساخن) وبالكحول بكتريا تسوس الاسنان Streptococcus mutans والمعزولة من بعض الأشخاص المصابين بالتسوس وعلى وسط MSBA (مختبريا) باستخدام طريقة انتشار القرص على وسط MHA، لاختبار المستخلصات لتحديد التركيز الأكثر تثبيطا لهذه البكتريا. وعند دراسة تأثير تراكيز المستخلصات المختلفة كان تركيز 75% لمستخلص حبوب البن الخضراء الكحولي هو الأكثر تثبيطا للبكتريا بمنطقة تثبيط قدرها 30.3 ملم يليها المستخلص المائي الساخن لحبوب البن الخضراء بقدرة تثبيط 27.5 ملم تليها المستخلص المائي الساخن للقهوة المحمصة بمقدار 20.5 ملم وأقلها تثبيطا بمقدار 20.8ملم عند استخدام نفس التركيز من المستخلص الكحولي لحبوب البن المحمصة. وكان تأثير المستخلص المائي البارد لحبوب البن المحمصة عند نفس التركيز قليلا بمقدار 12.3 ملم.
الكلمات المفتاحية: Streptococcus mutans، حبوب بن خضراء ومحمصة، نشاط ميكروبي، مستخلص مائي، مستخلص كحولي
Abstract: Coffee is among the most popular beverages to date all over the world primarily for its diverse effects. Moreover, coffee is known to contain various bioactive compounds with significant health benefits including antibacterial activities. Green and roasted coffee extracts, aqueous (cold, hot) and alcohol were tested against the dental caries bacteria Streptococcus mutans isolated from some people with caries on MSBA medium (in vitro) using the disk diffusion method on MHA medium, to determine the extracts on bacteria for inhibition concentration for these extracts. When studying the effect of different extract concentrations, the concentration of 75% for the alcoholic green coffee bean extract was 30.3 mm, followed by the hot aqueous extract of green coffee beans with an inhibition capacity of 27.5 mm, followed by the hot aqueous extract of roasted coffee with 20.5 mm and the least inhibition with 20.8 mm when using the same concentration of alcoholic extract of roasted coffee beans. The effect of the cold aqueous extract of roasted coffee beans at the same concentration was slight with 12.3 mm.
Keywords: Streptococcus mutans green and roasted coffee, aqueous and alcoholic extraction, antimicrobial activity.
المقدمة
يعد تسوس الأسنان أحد الأمراض الأكثر انتشارا وتكلفة والتي تؤثر على البشرية، وهو نتيجة للتفاعل بين البكتيريا الفموية والنظام الغذائي والأسنان والبيئة الفموية. تعتبر بكتريا ال Streptococcus mutans الموجبة لصبغة جرام المسبب الرئيسي لتسوس الأسنان عند الإنسان وخاصة الأطفال (Smith, 2018). فلهذه البكتيريا القدرة على تصنيع الجلوكان الغير قابل للذوبان في الماء من السكروز، والذي يساعد على التصاقها بأسطح الأسنان ويساهم في تكوين الأغشية الحيوية للأسنان. يعد تكوين الأغشية الحيوية أمرًا حيويًا لتطور تسوس الأسنان، وبالتالي فإن تثبيط هذا العامل هو إحدى الاستراتيجيات المستخدمة حاليًا للوقاية من هذا المرض (Xiao, Zhou, Feng, Hao, & Li, 2007). لهذا كرس الباحثون أنفسهم لدراسة المنتجات الطبيعية أو مكوناتها الكيميائية التي توفر الحماية ضد نمو البكتيريا وتكوين الأغشية الحيوية على الأسنانOsawa) وآخرون 2001 Thimothe, وآخرون 2007)
يعد البن من المشروبات الأكثر شعبية واستهلاكًا على نطاق واسع في جميع أنحاء العالم. وفي الآونة الأخيرة، زاد الاهتمام العلمي والشعبي بتأثيراتها على الصحة بسبب الخصائص الدوائية المفيدة التي أثبتتها الدراسات السريرية والوبائية مثل مضادات الالتهابات ومضادات الفطريات وخافضات السكر في الدم. (وأخرون 2003Johnston), (2007 Kendrickو Day) Ohshima et al., 2003, Rosengren et al., 2004 وقد سجلت العديد من النتائج ل
التي تثبت النشاط المضاد للبكتريا الموجبة والسالبة لصبغة جرام مختبريا لمستخلص حبوب البن. (Almeida et al., 2006, Almeida et al., 2004 Daglia et al 1994, Daglia et al., 1998, Daglia وأن هذا النشاط يتوافق مع التركيب الكيميائي للبن (Daglia et al., 1998) والتي قد تتأثر بأنواع حبوب البن سواء كانت خضراء أو محمصة. وطبقا لدراسة Daglia et al 2007، تبين أن المركبات الثانوية الموجودة في مستخلصات حبوب البن المحمصة مثل glyoxal, methylglyoxal، diacetyl كانت العوامل الرئيسية المسؤولة عن التأثير المثبط ضد وأن هذا النشاط تعزز في وجود الكافيين. ومن المركبات الكيميائية الفعالة الرئيسية التي يعتقد أنها لها نشاط مضاد لنمو بكتيريا Streptococcus mutans مثل المركبات الفينولية ((flavonoid، tannin، chlorogenic acid، alkaloids ((caffeine, trigonellin) Elshafieسنة 2023 و Wu H سنة 2022. ومع ذلك، تشير العديد من الدراسات إلى الخصائص المضادة للبكتيريا للمستقلبات الأولية مثل البروتينات والدهون.
الهدف من هذه الدراسة هو عزل بكتريا العقدية الطافرة Streptococcus mutans والتعرف على مدى تحسسها لمستخلصات حبوب البن الخضراء والمحمصة والمستخلصة مائيا بالبارد أو الساخن أو مستخلصة بالكحول الإيثيلي لعل استخدامه كمضمضة أو يدخل في تركيب معاجين الأسنان مستقبلا.
مواد وطرق البحث
عزل وتوصيف البكتريا Streptococcus mutans
تم عزل حوالي 50 مسحة لبكتريا المسببة لتسوس الأسنان من أفواه بعض الأشخاص المصابين بالتسوس من فئات عمرية مختلفة لكلا الجنسين من مصحات الأسنان في نطاق مدينة الخمس. تم زراعة العينات عل وسط الأجار المغذي Nutrient agar وحضنها لمدة 18-24 ساعة ب درجة37 ̊م ثم تنقل إلى الوسط Blood agar بعد ذلك شخصت العزلات مظهريا اتباعا لما ورد في Macfaddin, 2000) ) وتم عزل بكتريا S mutans عن بقيةىالعزلات الأخرى وذلك بعد طلاء العينة على Mitis Salivarius Agar وحضنها لا هوائيا anaerobically في الجار الشمعي Candel jar بدرجة حرارة 37 ̊م ثم تحضن هوائيا لمدة 18 ساعة في درجة حرارة الغرفة من تم رش الطبق بمحلول 10% من محلول المانيتول وحضنها هوائيا مرة أخرى 3 ساعات تقريبا عند درجة حرارة 37 ̊م بعد ذلك تم رش الطبق بمحلول 4% من ثلاثي فنيل رباعي كلوريد وحضن الطبق هوائيا مدة ساعة أخرى عند حرارة 37 حيث يشيلر التغير الى اللون الوردي الداكن الذي سيحدث للمستعمرة الى وجود بكتريا S. mutans بينما المستعمرات الأخرى والعقدية منها زرقاء اللون (Gold et al 1975).
الفحوصات المظهرية والمجهرية للبكتريا المعزولة:
بعد الحصول على عزلات من البكتريا قيد الدراسة وتم زرعها على وسط MSBA وBlood agar والتعرف على الشكل المظهري للمستعمرات من حيث اللون وشكل المستعمرة وحافتها وارتفاعها. وعلى الشكل المجهري حيث استدل على شكل الخلايا مجهريا بصبغة جرام وذلك بعد تثبيت مسحة من المستعمرة على الشريحة ثم صبغها ورؤية العقديات تحت المجهر الضوئي تبعا لما ورد في Collee) J.G 2006 ) .
الفحوصات البيوكيميائية للبكتريا المعزولة
تم إجراء التشخيصات البيو كيميائية للعزلات في مختبر الأحياء الدقيقة بكلية العلوم جامعة المرقب، وطبقا لما هو متبع في Browen (2007) ومن هذه الفحوصات الاندول والكاتاليز وإسالة الجيلاتين واليوريز احمر الميثيل والفوكس بروسكاور واستهلاك السترات وتخمر سكر اللاكتوز واختبار تحلل الدم (الهيمولايسين)، بعد ذلك تم حفظ العينات في الثلاجة لحين استخدامها في التجارب.
تجميع عينات حبوب البن:
تم جمع عينات حبوب البن الخضراء والمحمصة من الأسواق المحلية لمدينة الخمس. وتم إجراء عملية الاستخلاص للمركبات الفعالة بواسطة الكحول الإيثيلي تركيز 75% وبواسطة الماء على البارد والساخن.
استخلاص المركبات الفعالة من حبوب البن:
1-الاستخلاص المائي:
تبعا لطريقة Swanston وأخرون سنة 1990 تم استخلاص المكونات الفعالة من حبوب البن الخضراء أو المحمصة في وسط مائي للاستخلاص على البارد أو الساخن فبعد غسل عينات الحبوب بماء الحنفية متبوعا بالماء المقطر المعقم وبعد تجفيفها ثم طحنها بالهاون ووزن 30 جرام من مسحوق البن ووضعه بدورق زجاجي وإضافة الماء المقطر المعقم، وتركت في درجة حرارة المختبر لمدة 24 ساعة للاستخلاص على البارد أو التسخين إلى درجة الغليان للاستخلاص على الساخن كلا على حدة ثم توضع في المجمدة تحت درجة حرارة 10- 15 ̊م وبعد إسالة الخليط تم ترشيحه بإستخدام أوراق الترشيح ( ( Whatman no 1وبعد جمع الراشح تم تجفيفه في جهاز التبخير الدوار (Rotary evaporator)، وبعد تحديد الوزن الجاف لهذا المستخلص المائي البارد والساخن تم إذابتها في كمية معينة من الماء المقطر ومنها تم تحضير التراكيز المطلوبة ( 25%، 50%، 75% ) من المستخلص المائي البارد أو الساخن ثم تم تخزينها التجميد لحين إستعمالها في الاختبارات الحيوية.
2- الاستخلاص بالكحول الإيثيلي:
اتبعت طريقة Kumar and Parmar 1996)) في استخلاص بنفس طريقة الاستخلاص المائي ولكن بإستخدام الكحول الإيثيلي لفصل المواد الفعالة لحبوب البن الخضراء أو المحمصة وبعد التخلص من المذيب من الراشح المتحصل عليه في جهاز التبخير الدوار، من تم إذابتها في كمية معينة من الماء المقطر ومنها تحضير التراكيز المطلوبة (25%، 50%، 75%) من المستخلص ثم تخزن العينات في المجمدة لحين إستعمالها في التجارب.
تقدير تأثير المستخلصات المائية وبالكحول الايثيلي لحبوب البن على البكتريا المعزولة S. mutans
تم إتباع Berghe and Vlietinak 1991)) طريقة انتشار القرص (Disk diffusion method)، بعد تحضير معلق البكتريا قيد الدراسة وفقًا لمعيار ماكفارلاند 0.5. من المعلق يتم نقع طرف قطن معقم ونشره على وسط Mueller Hinton Agar ثم بعد غمر الأقراص ذات قطر 0.8 ملم في مستخلص البن المائي سواء المستخلص الساخن أو البارد أو مستخلص الكحولي كلا على حدا وبتراكيز 25%، 50%، 75% ووضعها على الوسط الغذائي Mueller-Hinton agar (MHA)، وأحد الأقراص تكون مشبعة المضاد الحيوي الكلورامفينيكول ذو الطيف الجرثومي الواسع (فعال ضد البكتريا السالبة والموجبة لصبغة جرام) يستخدم كنترول. بمعدل ثلاث مكررات لكل طبق. تحضن الأطباق عند درجة حرارة 37 ̊م لمدة 24 ساعة من تم يتم قياس قطر التثبيط حول هذه الأقراص وتسجل النتائج.
النتائج :
لقد أظهرت نتائج هذه الدراسة أن بكتريا S. mutans كانت الأعلى نسبة مقارنة بالأنواع الأخرى حيث سجلت حوالي 38% من مجموع باقي الأنواع البكتيرية كما هو موضح بالجدول رقم (1)، بينما كانت لبكتريا Staphylococcus aureus و بكتريا Lactobacillus sp نفس النسبة والتي هي 26% بينما كانت فرصة ظهور بكتريا Pseudomonas sp الأقل نسبة وهي 10%.
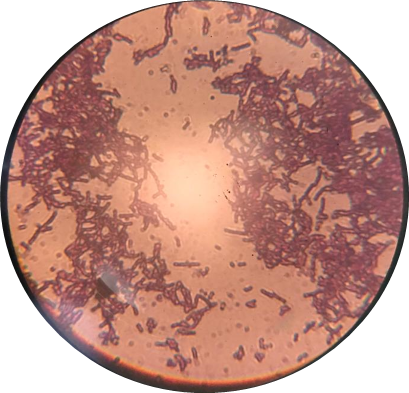
شكل رقم (1) يوضح لبكتريا Streptococcus mutans موجبة لصبغة جرام
جدول رقم (1) يوضح النسب المئوية لأجناس البكتريا المعزولة ل 50 حالة تسوس الأسنان.
|
البكتريا |
العدد |
النسبة |
|
Streptococcus mutans |
19 |
38% |
|
Staphylococcus aureus |
13 |
26% |
|
Lactobacillus sp |
13 |
26% |
|
Pseudomonas sp |
5 |
10% |
الخصائص المجهرية والمظهرية:
من خلال التوصيف المجهري أوضحت النتائج أنها مكورات سبحية موجبة لصبغة جرام كما موضح في الشكل رقم (2)، لاهوائية اختيارية وكانت الصفات المظهرية لهذه البكتريا لونها بيج إلى بني رمادي غامق مستعمراتها دائرية غير منتظمة، هوائية، مستعمراتها خشنة وكأنها مكسوة بالجليد، دائرية غير منتظمة، حوافها متموجة بالكامل، بينما الاختبارات البيوكيماوية التي أجريت مختبريا لتشخيص البكتريا S. mutans فوجد أنها سالبة لاختبار الكاتاليز وإسالة الجيلاتين بينما نجدها موجبة لاختبار اليوريز وتخمر سكر الجلوكوز وكان اختبار تحلل الدم (الهيمولايسين) من الفا (α)، هذه الاختيارات أكدت أن البكتريا المعزولة هي S. mutans كما موضح في الجدول رقم (2).
جدول رقم (2) الاختبارات البيوكيميائية التي تثبت ان بكتريا S. mutans المعزولة
|
نوع الاختبار |
النتيجة |
|
اختبار الكاتاليز |
– |
|
اختبار إسالة الجيلاتين |
– |
|
اختبار اليوريز |
+ |
|
اختبار قابلية البكتيريا علي تخمر سكر الجلوكوز |
+ |
|
اختبار تحلل الدم (الهيمولايسين) |
α(Hemolysis) |
|
فوكس بروسكاور |
+ |
التأثير التضادي لمستخلصات حبوب البن المائية (الساخن والبارد) والكحولية على بكتريا S. mutans
من خلال النتائج المتحصل عليها والموضحة في الجدول رقم (3) أظهرت كفاءة مستخلص حبوب البن الخضراء بالكحول الإيثيلي نجد تثبيط نمو البكتريا حيث كان هناك تراجع في نمو البكتريا بزيادة تركيز المستخلص فكانت منطقة التثبيط11 ملم، 20.8ملم، 30.3 ملم عند تركيز 25%، 50%، 75% على التوالي شكل رقم (1) بينما أظهرت البكتريا مقاومة لتراكيز المستخلص المائي البارد لحبوب البن الخضراء ولمستخلص المائي البارد لحبوب البن المحمصة عند تركيز 25%. كما منع مستخلص حبوب البن المحمصة بالماء الساخن نمو بكتريا S. mutans خصوصا عند تركيز 75% بقدرة تثبيط 27.5ملم وعند نفس التركيز والذي أظهر فعالية واضحة ضد البكتريا بحوالي 22.5 ملم و20.8ملم و12ملم لكلا المستخلص المائي الساخن لحبوب البن المحمصة، المستخلص الكحولي لحبوب البن المحمصة والمستخلص المائي البارد لحبوب البن المحمصة على التوالي. كما موضح في الأشكال (2، 3، 4) بالمقارنة مع حساسية البكتريا من المضاد الحيوي الكلورامفينيكول بنفس التراكيز وكانت مناطق الثبط أقل مما هو عليه في مستخلص حبوب البن الخضراء المستخلصة بالكحول. هناك العديد من الدراسات حول الخصائص المضادة لهذه البكتريا بإعتبارها ممرضة وللخصائص المركبات الفعالة التي تمتلكها حبوب البن سواء الخضراء أو المحمصة بالاستخلاص الكحولي أو المائي البارد والساخن، حيث ربطت هذه الدراسات بين التركيب الكيميائي للمركبات الفعالة في المستخلصات والفعالية الحيوية لها.
جدول رقم (3) يوضح قطر مناطق التثبيط لبكتريا S. mutans بواسطة تراكيز مستخلصات حبوب البن
|
نوع المستخلص |
منطقة التثبيط عند التراكيز المختلفة |
||
|
25% |
50% |
75% |
|
|
المستخلص الكحولي حبوب البن الخضراء |
11ملم |
20.8ملم |
30.3ملم |
|
المستخلص الكحولي حبوب البن المحمصة |
9ملم |
10.2ملم |
20.8ملم |
|
المستخلص المائي البارد حبوب البن الخضراء |
– |
– |
– |
|
المستخلص المائي البارد حبوب البن المحمصة |
– |
11ملم |
12.3ملم |
|
المستخلص المائي الساخن لحبوب البن الخضراء |
6 ملم |
11.5 ملم |
27.5 ملم |
|
المستخلص المائي الساخن للحبوب البن المحمصة |
8 ملم |
17.5ملم |
22.5 ملم |
|
المضاد الحيوي الكلورامفنيكول |
12ملم |
19 ملم |
21 ملم |
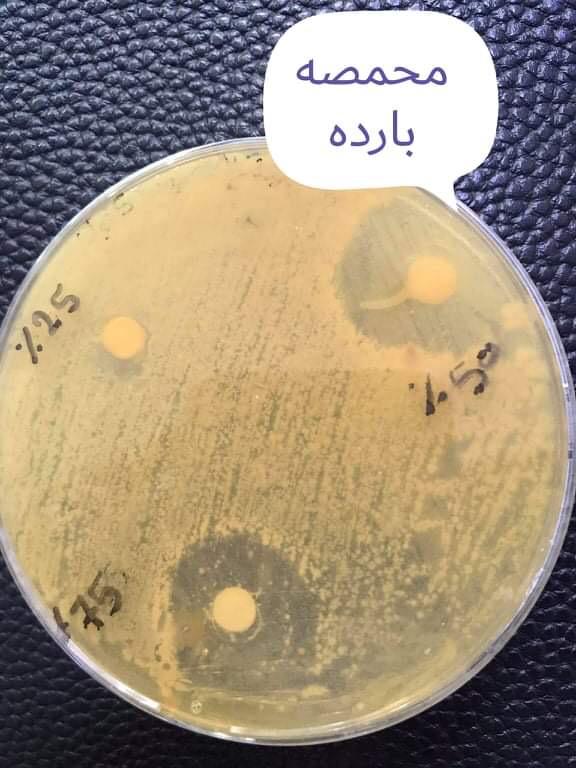
شكل (1) يوضح قطر التثبيط تراكيز مستخلص حبوب البن المحمصة الكحولي على بكتريا S. mutans
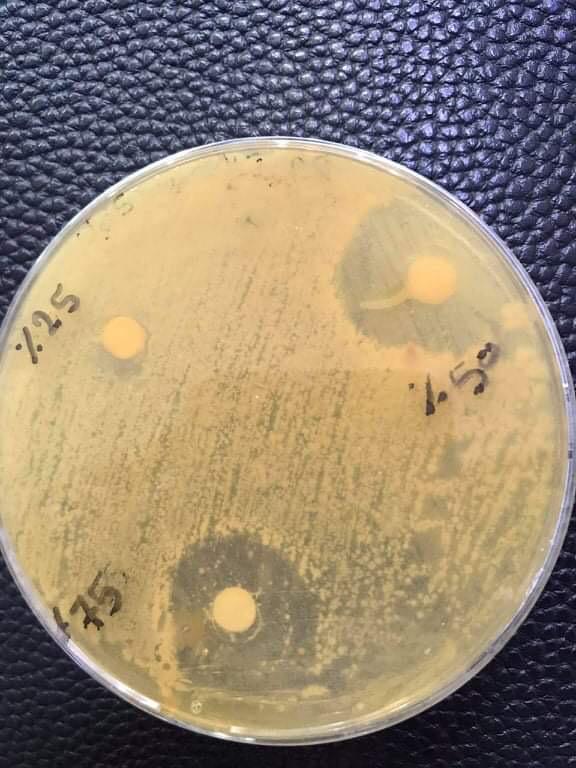
شكل رقم (2) يوضح قطر تثبيط تركيز مستخلص حبوب البن المائي البارد على بكتريا S. mutans
 شكل رقم (3) يوضح تأثير تثبيط تركيز مستخلص حبوب البن الخضراء الكحولي على بكتريا S. mutans
شكل رقم (3) يوضح تأثير تثبيط تركيز مستخلص حبوب البن الخضراء الكحولي على بكتريا S. mutans
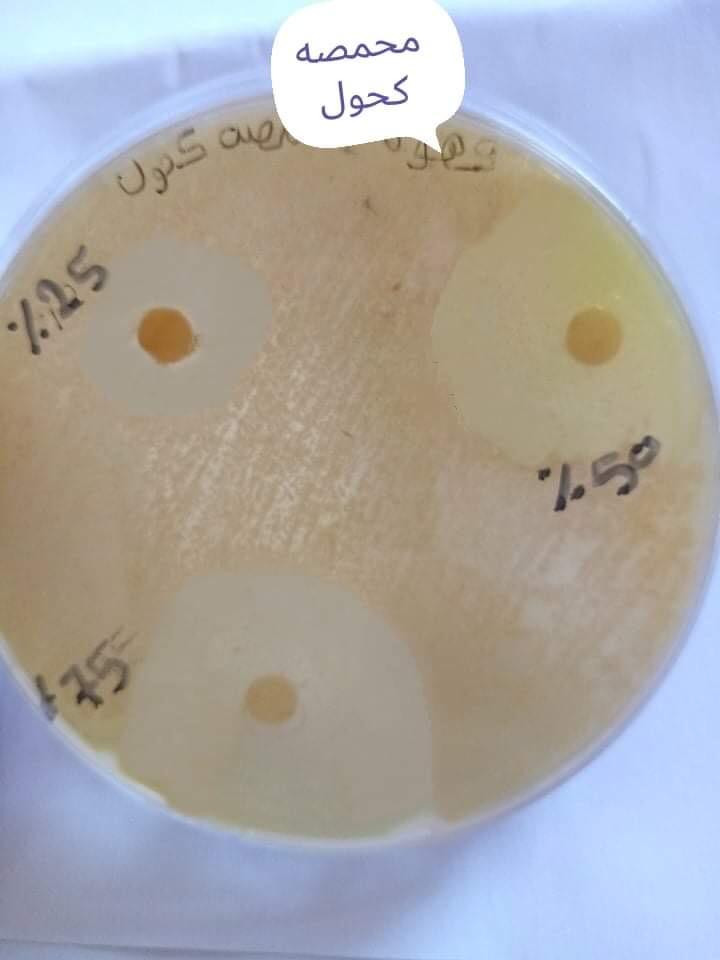
شكل رقم (4) يوضح تأثير تثبيط مستخلص المائي الساخن حبوب البن المحمصة على بكتريا S. mutans
المناقشة
قد يكون استخدام المنتجات الطبيعية كجزء من النظام الغذائي اليومي بديلاً أكثر فعالية وأمانًا للوقاية من الأمراض (Naim &Tariq,2006)، ففي هذه الدراسة قمنا بالتحقق من فعالية مستخلصات حبوب البن المائية وبالكحول ضد بكتريا Streptococcus mutans التي تسبب تسوس للأسنان والتي تؤثر بشكل كبير على الصحة العامة للفرد حيث تنتقل من الأم إلى الطفل عبر نقل موروثات فهي الأكثر شيوعا لدى الأطفال والرضع (Javed 2013).
لقد أثبتت الدراسات أن المستخلصات المائية من حبوب البن تأثيرات مضادة للبكتيريا Streptococcus sp يرجع السبب في هذا التضاد انه حبوب البن تحتوي على مركبات فينولية وفلافونويد والتي قد تكون مسؤولة عن التأثير المضاد للبكتيريا Farag) وآخرون سنة 1989). ولقد تم اعتبار تثبيط وظيفة غشاء الخلية واستقلاب الطاقة من الآليات المحتملة لعمل الفلافونويد ضد البكتيريا (Deans وآخرون1989) بالإضافة إلى ذلك، تعمل المركبات الفينولية على تحلل بروتينات الخلايا البكتيرية وتمنع تكاثر الخلايا. وتشير دراسات أخرى أن المركبات الكيميائية الموجودة فالقهوة مثل الكافيين والاحماض العضوية المتطايرة والغير متطايرة والفينولات والكيتونات والالدهيدات وكذلك المركبات العطرية والتي لها نشاط فعال مضاد للميكروبات (Harry, greath 1983). وان حبوب البن الخضراء تحتوي على حمض الكلورجينيك والذي يفقد منه حوالي 30%- 50% أثناء التحميص وعند الاستخلاص بالكحول الايثيلي قد تظهر هذه المركبات التي لها دور مهم في القضاء على البكتريا السالبة والموجبة لصبغة جرام. Davidson, Herald 1983)) و ( (Fardiaz, 1990. كما لوحظ ان المستخلصات الكحولية خصوصا عند الأكثر تركيزا 75% كانت أكثر كفاءة من المستخلصات المائية وذلك لطبيع قطبية هذا المذيب في إستخراج المواد الفعالة الموجودة في حبوب البن الخضراء أو المحمصة وهذا ما وصل اليه Geraldi) وآخرون, 2022). أشارت النتائج إلى الفوائد الطبية المحتملة لمستخلصات حبوب البن في تثبيط نمو البكتريا خصوصا في التراكيز العالية الكحولية في هذه الدراسة والتي تتحكم في إنتاج الأغشية الحيوية التي تتكون على الأسنان تسبب تسوسها وأمراض الفم واللثة.
الخاتمة:
أظهرت نتائج هذه الدراسة التأثير المضاد لحبوب البن الخضراء والمحمصة فعالية ضد بكتريا تسوس الأسنان، وأن المركبات الفينولية والفلافونويد والكافيين التي قد تكون لها تأثير في هذه الدراسة ضد البكتريا، وكان المستخلص الكحولي لحبوب البن الخضراء أكثر فعالية من المائية لنفس الحبوب والمحمصة أيضا خصوصا عند التركيز 75% والذي يحتوي على حمض الكلور جينيك الذي له فعالية كبيرة ضد الميكروبات كما في الدراسات السابقة المشار اليها في الدراسة التي تحتويها حبوب البن الخضراء وأظهر قدرتها التثبيطية الكحول الإيثيلي.
التوصيات:
- دراسة نشاط لمستخلصات حبوب البن الخضراء والمحمصة، وفعاليتها التثبيطية على بكتريا أخرى ممرضة.
- دراسة كفاءة المركبات الفعالة المستخلصة من حبوب البن الخضراء والمحمصة مع استخدام مذيبات عضوية أخرى مع إمكانية تحديد التركيز الأمثل للمستخلصات.
- دراسة تضادية هذه المستخلصات على تكوين الأغشية الحيوية للبكتريا قيد الدراسة.
- إمكانية استخدام هذه المستخلصات كبديل طبيعي لغسول الفم وإضافتها لمعاجين الأسنان للوقاية من تسوس الأسنان.
- دراسة التراكيب الكيميائية لهذه المستخلصات والتعرف على تأثيراتها جانبية بعد تجريبها على الحيوانات ت المختبرية ليتم التعرف على تأثيرها على الصحة العامة
References
Almeida, A. A. P., et al. (2004). Antimicrobial activity of coffee against Escherichia coli and Staphylococcus aureus. Journal of Food Protection, 67(5), 923-926.
Almeida, A. A. P., et al. (2006). Chemical composition and antimicrobial activity of coffee. Journal of Food Science, 71(6), S207-S212.
Brown, T. A. (2007). Biochemical tests for bacterial identification. Journal of Clinical Microbiology, 45(9), 3043-3048.
CLSI, Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; 2015.Approved Standard, 10th ed. CLSI document M07-A10, Wayne, PA, USA, Clinical and Laboratory Standards Institute,
Collee, J. G. (2006). In memoriam–Marler Thomas Parker (1912– 2006). Journal of Medical Microbiology, 55(8), 971-973.
David, J., & Herald, C. (1983). Isolation and identification of active compounds from coffee. Journal of Agricultural and Food Chemistry, 31(5), 1082-1086.
Deans, S.G., Svoboda, K.P. 1989. Antimicrobial activity of summer savory (Satureja hortensis L.) essential oil and its constituents.J. Horticultural Sci.64:205-210.d Science Nutrition.
Diglia, M., et al. (1994). Inhibition of bacterial growth by coffee extracts. Journal of Food Science, 59(3), 527-531.
Diglia, M., et al. (1998). Antimicrobial activity of coffee extracts against foodborne pathogens. Journal of Food Protection, 61(9), 1168-1172.
Diglia, M., et al. (2007). Antimicrobial and antioxidant activity of coffee. Journal of Medicinal Food, 10(3), 504-509.DOI: 10.1089/jmf.2006.25
Elshafie HS, Camele I, Mohamed AA. (2023). A Comprehensive Review on the Biological, Agricultural and Pharmaceutical Properties of Secondary Metabolites Based-Plant Origin. International journal of Molecular Science. 24(4).
Farag R.S.;Daw Z.Y.;Hewedi F.M.;EL-Baroty G.S.A.,(1989) .Antimicrobial activity of some Egyptian spice essential oils.J.Food Protection 52:665-667.
Fardiaz, D. (1990). Isolation and identification of active compounds from Indonesian medicinal plants. Journal of Ethnopharmacology, 29(2), 157-164.
Geraldi, A., Wardana, A. P., Aminah, N. S., Kristanti, A. N., Sadila, A. Y., Wijaya, N. H. and Manuhara, Y. S. W. (2022). Tropical Medicinal Plant Extracts from Indonesia as Antifungal Agents.
Geraldine, R., et al. (2022). Optimization of green coffee extraction using response surface methodology. Journal of Food Science and Technology, 59(4), 1468-1476.
Gold, O. G., Jordan, H. V., & Van Houte, J. (1975). The prevalence of enterococci in the human mouth and their pathogenicity in animal models. Archives of oral biology, 20(7), 473-IN15.
Harry, T. & Greath, D. (1983). Antimicrobial agents from plants. In: “Plant Secondary Metabolites” (eds. P.M. Dey, J.B. Harborne), pp. 237- 253. Academic Press.
Heatley,N.G (1944). A method for the assay of penicillin,” The Biochemical Journal, vol. 38, no. 1, pp. 61–65.
Javed, M. (2013). Transmission of streptococcas mutans from mother to child.
Johnston, K. L., Clifford, M. N., & Morgan, L. M. (2003). Coffee consumption and inflammation: A review of the evidence. International Journal of Food Sciences and Nutrition, 54(5), 329-336.
Kendrick, A. S., & Day, B. J. (2007). Coffee consumption and inflammation: A review of the evidence. Journal of Alzheimer’s Disease, 13(2), 151-165.
Kumar, V., & Parmar, B. S. (1996). Extraction of active compounds from plants: A review. Journal of Scientific and Industrial Research, 55(10), 751-762.
Mac Faddin J.E. (2000). biochemal test For bacteria .3nd and the Williamms and Wilkins .London McGraw Hill. ISBN 0-8385-8529-9
Naim, A.,Tariq, P.(2006). Evolution of antibacterial activity of decoction, infusion and essential oil of Origanum vulgare on methicillin resistant and methicillin sensitive Staphylococcus aureus. International Journal of Biology and Biotechnology.3(1):121-125.
Ohshima, T., et al. (2003). Chlorogenic acid and caffeine in coffee inhibit inflammation-induced gene expression in human umbilical vein endothelial cells. Journal of Nutrition, 133(9), 2775-2779.
Osawa K, Miyazaki K, Shimura S, Okuda J, Matsumoto M, Ooshima T .(2001). Identification of cariostatic substances in the cacao bean husk: their anti glucosyltransferase and antibacterial activities. J Dent Res;80:2000–2004.
Rosengren, A., Dotevall, A., Wilhelmsen, L., & Johansson, S. (2004). Coffee consumption and mortality: A 13-year follow-up of the Göteborg cohort. Journal of Internal Medicine, 255(3), 286-294.
Smith,L. A.,Tumilty E.,Page, L. F.,Thomson, W. M., & Gibson, B. (2018). Children’s rights in their oral health care: How responsive are oral health professionals to children’s rights. The International Journal of Children’s Rights, 26(2), 354-378.
Swanston, J. S. (1990). Extraction of bioactive compounds from plant materials using cold water. Journal of Agricultural and Food Chemistry, 38(5), 1387-1391.
Thimothe, J., Béné, K., Delattre, C., Dubourdeaux, M., & Baudoux, D. (2007). Antimicrobial and antibiofilm activity of extracts from tropical medicinal plants against Streptococcus mutans. Journal of Ethnopharmacology, 113(3), 472-478.
Wu H, Lu P, Liu Z, Sharifi-Rad J, Suleria HAR.(2022). Impact of roasting on the phenolic and volatile compounds in coffee beans.
Xiao J, Zuo Y, Liu Y, Li J, Hao Y, & Zhou X (2007). Effects of Nidus Vespae extract and chemical fractions on glucosyltransferases, adherence and biofilm formation of Streptococcus mutans. Arch Oral Biology, 52(9), 869–875.
